Neue Sortierung: Forscher haben erstmals ein Periodensystem zusammengestellt, in dem die Elemente nach der Füllung ihrer Kernschalen gruppiert werden – und damit nach der Zahl ihrer Protonen. Denn ähnlich wie die Elektronenzahl das chemische Verhalten der Elemente bestimmt, beeinflussen die Kernschalen und ihre „magischen Zahlen“ das Aussehen und Verhalten der Atomkerne – und das macht die neue Anordnung nun sichtbar.
Das Periodensystem der Elemente bildet die Grundlage der Chemie. Denn die Position eines Atoms in dieser Tabelle verrät nicht nur sein Atomgewicht und die Zahl der Protonen im Kern. Sie erlaubt auch Rückschlüsse darüber, wie viele Elektronen es in seiner Hülle trägt und wie es sich daher in Bindungen und chemischen Reaktionen verhält.
Schalen im Atomkern und „magische Zahlen“
Doch die Orbitale der Elektronenhülle sind nicht das einzige Ordnungsprinzip in den Atomen. Forscher vermuten schon länger, dass es auch im Atomkern quantenmechanisch bedingte „Schalen“ gibt, die von den Protonen und Neutronen sukzessive aufgefüllt werden. Analog zu den Elektronenschalen könnten dabei volle Kernschalen energetisch vorteilhaft sein und diesem Atomkern eine größere Stabilität verleihen.
„Wenn diese nuklearen Orbits mit Protonen aufgefüllt sind, bilden sie stabile Kerne – ähnlich wie bei den Elektronenorbitalen die stabilen Edelgase“, erklärt Kouichi Hagino von der Universität Kyoto. Tatsächlich zeigen Beobachtungen, dass Atomkerne mit bestimmten Protonen- oder Neutronenzahlen eine höhere Bindungsenergie besitzen. Bei radioaktiven Isotopen zeigt sich diese „magische Zahl“ in einer längeren Halbwertszeit.
Bei den Protonen scheint eine volle Kernschale jeweils bei 2, 8, 20, 28, 50 und 82 erreicht zu sein – dies entspricht den Elementen Helium, Sauerstoff, Calcium, Nickel, Zinn und Blei. Tatsächlich sind diese Elemente besonders stabil und besitzen auch vergleichsweise viele stabile Isotope.
„Magische Gruppe“ statt Edelgase
Um diese Struktur des Atomkerns und ihren Einfluss deutlich zu machen, haben Hagino und sein Kollege Yoshiteru Maeno jetzt ein Periodensystem entwickelt, in dem die Elemente nicht nach ihren Elektronenhüllen gruppiert sind wie sonst üblich, sondern nach ihren Kernschalen. „In unserem nuklearen Periodensystem platzieren wir alle Elemente mit magischen Zahlen in einer Spalte – ähnlich wie in der gängigen Tabelle die Edelgase“, erklären die Forscher.
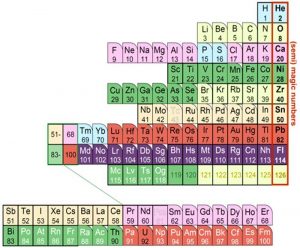
Dadurch ergibt sich eine Tabelle, bei der alle Elemente mit voller Protonzahl in den Kernschalen untereinander stehen. Ebenfalls mit in dieser „magischen Gruppe“ steht Zirkonium mit 40 Protonen, weil dieses Element wahrscheinlich eine volle Protonen-Unterschale besitzt und daher eine Art „halbmagische Zahl“ aufweist, wie Hagino und Maeno erklären.
Tabellenposition verrät Kernform
Im neuen nuklearen Periodensystem ist der Zustand der Kernschalen jedes Elements leicht zu erkennen: Je weiter ein Element von der „magischen Gruppe“ entfernt steht, desto weiter sind seine Protonen-Kernschalen vom energetisch optimalen Zustand entfernt. „Natürlich könnte man auch eine ganz ähnliche Tabelle für die Neutronen und ihre magischen Zahlen aufstellen, aber weil die Protonen die Elementzugehörigkeit bestimmen, ist dies übersichtlicher und einfacher“, erklären die Forscher.
Gleichzeitig verdeutlicht diese Tabelle ein weiteres Merkmal der Atomkerne: Alle Angehörigen der magischen Gruppe besitzen kugelförmige Kerne, wie die Wissenschaftler erklären. Das gleiche gilt auch für die meisten ihrer unmittelbaren Nachbarn, die nur ein Proton zu viel oder wenig haben. Anders dagegen die Elemente, deren Kernschalen nur etwa halb gefüllt sind: Sie sind selbst im Grundzustand deformiert und haben daher eine leicht elliptische Form.
Nützliche Ergänzung zur klassischen Tabelle
Nach Ansicht der beiden Forscher ist ihr nukleares Periodensystem eine nützliche Ergänzung zur gängigen Elementtabelle – gerade auch in der Lehre. Denn sie illustriert, dass die Eigenschaften der Atome und Elemente sowohl von ihrer Elektronenhülle wie auch von der Struktur ihres Kerns geprägt werden. Sie hoffen, dass Akademiker und Chemie-Fans sich an diesem frischen, etwas anderen Blick auf die Elemente erfreuen. (Foundations of Chemistry, 2020; doi: 10.1007/s10698-020-09365-5)
Quelle: Kyoto University















