Typischerweise kennen wir das Periodensystem als geometrische, farbige Tabelle. Doch man kann die Welt der Elemente auch als Landkarte betrachten. Darin bilden die stabilen, langlebigen Atomsorten den festen Kontinent, dessen Küsten von Schwermetallen wie Quecksilber und Blei gesäumt werden. Der Landmasse vorgelagert sind flache, sumpfige Untiefen – radioaktive Elemente mit längeren Halbwertszeiten von einigen Jahren bis Jahrmillionen.
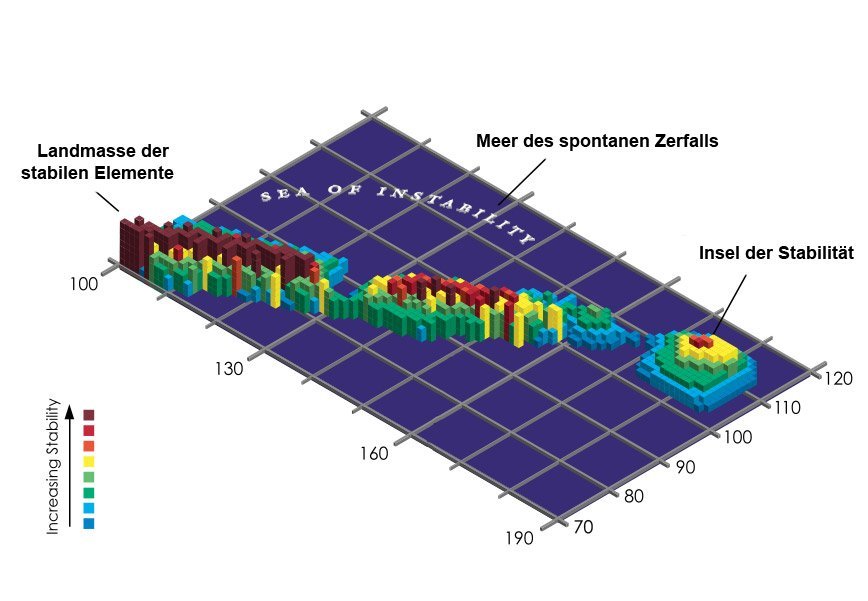
Die Insel der Stabilität
Doch je weiter man sich vom Ufer entfernt, desto tiefer wird das Wasser. Hier ist das Reich der kurzlebigen superschweren Elemente – der Atome, die kaum lange genug bestehen, um nachgewiesen zu werden. Doch nach Ansicht der Elementjäger könnte es irgendwo inmitten dieser unerforschten See noch Inseln der Stabilität geben. Sie bestehen aus den neutronenreichen Isotopen superschwerer Elemente, die stabiler sind als die umgebenden Atomvarianten.
„Wenn wir die Insel der Stabilität finden, lernen wir dabei viel über das Wesen der Kräfte, die in Atomkernen wirken – also darüber, was die Welt im Innersten zusammenhält“, erklärt Klaus Blaum von Max-Planck-Institut für Kernphysik in Heidelberg. Er und seine Kollegen haben kürzlich eine Methode entwickelt, um die Masse und damit die Neutronenzahl superschwerer Elemente besser messen zu können. Dies ist eine wichtige Voraussetzung, um die Insel der Stabilität zu identifizieren.
Nähern wir uns dem Ufer?
Ein erstes Indiz für die Existenz einer solchen stabilen Insel lieferte vor einigen Jahren das Isotop Hassium-270. Dessen Atomkerne mit 108 Protonen und 162 Neutronen sind zwar instabil. Aber Experimente legen nahe, dass dieses Isotop immerhin rund 20 Sekunden lang überdauert, bevor es zerfällt – das ist wesentlich länger, als aufgrund seiner Protonenzahl zu erwarten wäre.
Auch das stabilste Isotop des Fleroviums (114) hat mit rund fünf Sekunden eine überraschend lange Halbwertszeit. Nach Ansicht vieler Kernphysiker könnte dies ein Hinweis darauf sein, dass man sich mit den jüngsten Neuzugängen im Periodensystem der gesuchten Insel der Stabilität nähert. Doch wie kommt eine solche Insel zustande? Was macht diese superschweren Isotope stabiler als ihre „Geschwister“?
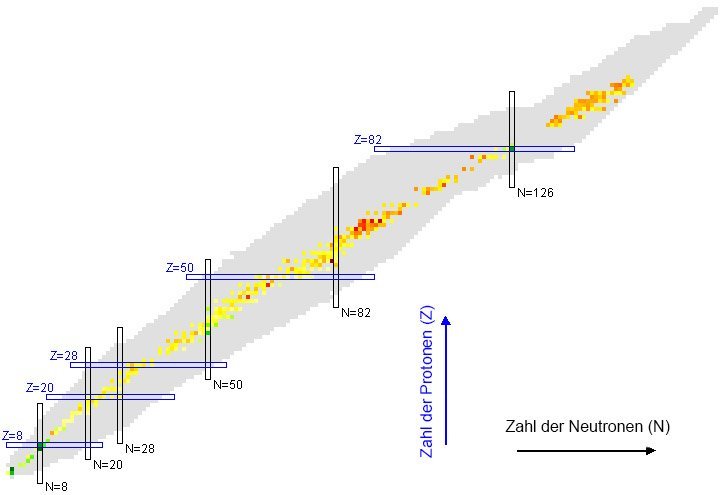
Die magischen Zahlen
Einen Hinweis auf die Antwort erhielten Wissenschaftler schon in den 1950er Jahren. Denn sie stellten fest, dass Atomkerne mit einer bestimmten Zahl von Kernbausteinen stabiler sind als andere. Besitzt beispielsweise ein normalerweise radioaktiver Atomkern eine solche „magische Anzahl“ von Protonen oder Neutronen, zerfällt er deutlich später als gleich schwere Atomkerne mit anderen Nukleon-Anteilen. Und bei stabilen Elementen zeigen sich Sprünge in der Bindungsenergie der Atomkerne – bei bestimmten Zahlenverhältnissen ist sie auffallend hoch.
Für Protonen sind die Zahlen 2, 8, 20, 28, 50 und 82 „magisch“. Von dieser Magie profitieren daher die Elemente Helium, Sauerstoff, Calcium, Nickel, Zinn und Blei. Sie sind besonders stabil und besitzen auch vergleichsweise viele stabile Isotope. So hat Zinn zehn stabile Atomvarianten, Calcium immerhin noch fünf. Für die Neutronen im Atomkern gelten die gleichen magischen Zahlen. Sie sorgen beispielsweise dafür, dass das Isotop Calcium-48 trotz seines Neutronenüberschusses von 28 Neutronen gegenüber 20 Protonen stabiler ist als sein „Nachbar“ Calcium-47.
Es gibt auch Isotope, die gleich zwei magische Zahlen in sich vereinen – sie sind gewissermaßen doppelt magisch. Dazu gehören Helium-4, Sauerstoff-16 und Calcium-40, aber auch das schwere Blei-208. Seine 126 Neutronen belegen, dass zumindest für Neutronen auch 126 zu den magischen Zahlen gehört.
Schalen im Atomkern
Aber warum? Kernphysiker gehen heute davon aus, dass dies an der inneren Struktur des Atomkerns liegt. Ähnlich wie die Elektronen in der Hülle sukzessiv bestimmte Energieniveaus auffüllen, scheint dies auch bei den Nukleonen im Kern der Fall zu sein. Auch bei ihnen gibt es offenbar quantenmechanisch begründete Schalen, die jeweils eine bestimmte Anzahl von Protonen oder Neutronen aufnehmen. Sind sie dann komplett gefüllt, ist dies energetisch günstig und der Kern deshalb besonders stabil. Diese Zustände entsprechen jeweils den magischen Zahlen.
„Das ist wie ein Ringelreihenspiel mit Kindern, bei denen der tanzende Ring geschlossen ist“, erklärt Blaum. „Für weitere Kinder wird es dann schwieriger, noch hinein zu kommen.“ Ausgehend von diesem Modell prognostizieren die Kernphysiker, dass die nächste magische Zahl für die Protonen bei 126 und für Neutronen bei 184 liegen könnte. Isotope mit diesen Werten könnten damit theoretisch mitten auf der Insel der Stabilität liegen.
Bisher allerdings ist diese Insel noch unerreichbar. Die bisher neutronenreichsten Isotope sind Livermorium-293 und Tenessine-294 mit jeweils 177 Neutronen. Bei den Protonen stecken die Elementjäger vorerst bei Oganesson mit 118 fest. Ob man die Insel der Stabilität jemals erreichen wird, ist daher ziemlich ungewiss.