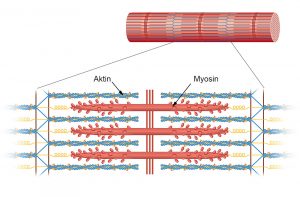
Subtile Unterschiede: Forscher haben herausgefunden, warum die Herzen kleiner Tiere viel schneller schlagen als das menschliche Herz – molekulare Unterschiede in der Muskelfaser sind schuld. Demnach gibt es zwölf Positionen im Myosin-Molekül der Herzmuskeln, an denen mit zunehmender Körpergröße einer Spezies Aminosäuren ausgetauscht werden. Werden bei einem menschlichen Beta-Myosin einige dieser Ersetzungen rückgängig gemacht, kontrahieren die Muskelfasern wieder fast so schnell wie die einer Ratte.
Muskeln sind ein komplex konstruiertes Wunder der Natur: Jede Muskelfaser besteht aus nur einer einzigen, vielkernigen Zelle, in der Bündel aus langgestreckten Proteinfasern liegen. Diese kettenförmigen Myosin- und Aktinmoleküle greifen mit winzigen Hebelchen so ineinander, dass sie sich gegeneinander verschieben und den Muskel entweder kontrahieren oder entspannen können. Wie schnell sich ein Muskel bewegen kann, hängt davon ab, mit welcher Geschwindigkeit diese Fasern ihre maximale Kontraktion erreichen können.
Warum schlagen größere Herzen langsamer?
Das Interessante jedoch: Obwohl die Muskeln bei allen Säugetieren aus den gleichen Proteinen aufgebaut sind, verhalten sie sich unterschiedlich. Denn das maximale Kontraktionstempo ihrer Muskeln variiert um mehr als das Fünffache. Am deutlichsten messbar ist dies beim Herzmuskel: Je kleiner ein Tier ist, desto schneller schlägt sein Herz. Während das menschliche Herz beispielsweise im Schnitt 70-mal in der Minute schlägt, pumpt das Herz einer Ratte in der gleichen Zeitspanne rund 300-mal.
Aber warum? Welche molekularen Mechanismen dahinterstecken, haben nun Chloe Johnson von der University of Kent und ihre Kollegen näher untersucht. Dafür nahmen sie die Feinstruktur des Muskelproteins Myosin näher ins Visier. „Proteine können ihre Funktionen an die spezifischen Anforderungen des Organismus anpassen“, erklären sie. Schon der Austausch einer oder weniger Aminosäuren im Protein kann dabei Auswirkungen auf seine Funktion haben, ohne dass das Protein dadurch seine grundsätzliche Identität ändert.
Subtile Unterschiede in der Myosin-Sequenz
Für ihre Studie haben die Forschenden die Aminosäuresequenz der Beta-Myosine von 67 verschiedenen Säugertierarten verglichen, dem Protein, das in langsamen Muskelfasern und im Herzmuskel arbeitet. Ihren Schwerpunkt legten sie dabei auf die sogenannte Motordomäne, den rund 800 Aminosäuren langen Abschnitt des Myosins, der für die Muskelbewegung entscheidend ist. Die Spanne der untersuchten Spezies reichte dabei von nur sechs Gramm leichten Mäusen bis zu mehr als zehn Tonnen schweren Pottwalen.
Es zeigte sich: Beim Myosin des Herzmuskels gibt es zwölf Aminosäure-Positionen, die sich in engem Zusammenhang mit der Körpergröße verändern. Gegenüber der Maus als einem der kleinsten untersuchten Tiere werden diese Aminosäuren bei den anderen Säugetiere mit zunehmender Körpergröße ausgetauscht. „Die beobachteten Trends legen nahe, dass es dabei eine bestimmte Reihenfolge gibt, in der die Aminosäuren an diesen zwölf Stellen wechseln – vom kleinesten Tier zum größten“, berichten Johnson und ihre Kollegen.
Mensch hat neun ersetzte Aminosäuren
Auch der Mensch zeigt diese Aminosäure-Wechsel: Unser Beta-Myosin unterscheidet sich von dem der Ratte an neun Positionen. „Innerhalb der gesunden menschlichen Populationen gibt es dabei kaum Variationen“, erklären die Forschenden. „Das legt nahe, dass diese Veränderungen artspezifisch sind.“ Von vielen Herzkrankheiten ist jedoch bekannt, dass Mutationen im Myosin eine wichtige Rolle spielen können.
Um zu überprüfen, ob die artspezifischen Aminosäure-Veränderungen einen direkten Einfluss auf das Kontraktionstempo der Herzmuskelfasern haben, erzeugte das Forschungsteam Chimären: Sie tauschten in menschlichen Herzmuskelzellen die neun menschenspezifischen Aminosäuren gegen ihre Ratten-Gegenparts aus. Dann testeten sie, wie dies das maximale Kontraktionstempo der Muskelfasern beeinflusste.
Ratten-Sequenz macht menschliches Myosin schneller
Das Ergebnis: Das menschliche Beta-Myosin kann sein Aktin-Gegenüber normalerweise um 0,49 Mikrometer pro Sekunde verschieben. Das durch die Ratten-Aminosäuren veränderte Chimären-Myosin schaffte dagegen 0,9 Mikrometer pro Sekunde – es bewegte sich damit doppelt so schnell. „Das legt nahe, dass die Sequenzveränderungen an diesen Positionen des Myosins dafür verantwortlich sind, dass größere Tiere einen langsameren Herzschlag entwickelten“, sagt Johnson.
Die Analysen enthüllten auch, auf welche Weise die Mutationen das Muskeltempo beeinflussen: Die bei kleinen Säugetieren typische Sequenz bewirkt, dass ihr Beta-Myosin schneller das Molekül Adenosindiphosphat (ADP) freisetzt. Dieses entsteht, wenn die Muskelfaser das energiereiche Adenosintriphosphat (ATP) bindet und unter Energiegewinn ein Phosphat abspaltet. Je schneller das „Abfallprodukt“ ADP dann wieder abgegeben wird, desto schneller kann auch der Muskel arbeiten.
„Die experimentelle Charakterisierung des Chimären-Myosins demonstriert, dass die Aminosäure-Ersetzungen die Rate der ADP-Freisetzung kontrollieren und damit den limitierenden Schritt im Myosin-Zyklus“, erklären die Forschenden.
Molekulare Bremse
Zusammengenommen legen diese Ergebnisse nahe, dass die Herzschlagrate der Säugetiere von einem molekularen „Timer“ bestimmt wird: Schon der Austausch nur weniger Aminosäuren im Beta-Myosin der Herzmuskelfasern sorgt demnach dafür, dass die Muskelkontraktion bei größeren, massereicheren Tieren gebremst wird. Je größer eine Tierart dabei ist, desto mehr dieser Aminosäure-„Bremsen“ weist ihr Myosin dabei auf, wie Johnson und ihr Team herausgefunden haben.
Diese Anpassung ermöglicht es den größeren Herzen dieser Tiere, angepasst an ihr Volumen effektiv, aber ohne Überanstrengung zu schlagen. (PLOS Biology, 2021; doi: 10.1371/journal.pbio.3001248)
Quelle: PLOS