Natürlicher Abbau: Forschende haben erstmals ein Enzym entwickelt, das eine schwer zugängliche chemische Bindung in Silikonen aufbrechen kann. Es verändert das Material so, dass die hartnäckige Bindung zwischen Silizium und Kohlenstoff in solchen Siloxanen gespalten wird. Dank des neuen Biokatalysators könnten diese umweltbedenklichen Massenchemikalien künftig biologisch abbaubar sein, wie die Biochemiker in „Science“ berichten.
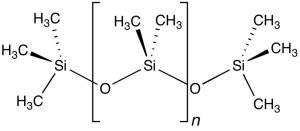
Siloxane, auch Silikone genannt, kommen in unzähligen Alltagsprodukten vor – von Reinigungs- und Pflegeprodukten über Autos und elektronische Geräte bis hin zu Raumfahrttechnik. Die Polymere sind stabil und zugleich flexibel und verfügen über organische und anorganische Elemente. Wegen dieser und weiterer Eigenschaften sind Siloxane auch ein beliebtes Baumaterial und kommen auch in der Medizintechnik zum Einsatz. Jährlich werden einige Megatonnen dieser Chemikalien hergestellt und verarbeitet.
Menschgemachte Chemikalie gefährdet die Umwelt
Das chemische Grundgerüst der Siloxane besteht aus Silizium-Sauerstoff-Bindungen. An die Siliziumatome sind zudem kohlenstoffhaltige Gruppen, häufig Methylgruppen, gebunden. Solche Silizium-Kohlenstoff-Bindungen kommen in der Natur nicht vor, werden von Menschen jedoch seit etwa 80 Jahren künstlich hergestellt und genutzt.
Wenn die Siloxane in die Umwelt gelangen, zerfallen sie in kleinere Teile und können als Schwebstoffe in die Atmosphäre gelangen. Dort reagieren die Teilchen mit freien Radikalen, zerfallen weiter und sammeln sich so in der Natur an. Über mögliche Umwelt- und Gesundheitsrisiken dieser Abbauprodukte ist nur wenig bekannt, es gibt jedoch Hinweise daraus, dass sie für manche Lebewesen giftig sein könnten. Zudem kann dieser Zerfallsprozess Monate dauern. Als letztes brechen dabei die robusten Silizium-Kohlenstoff-Bindungen auf.
Mit gerichteter Evolution zu besseren Enzymen
Um diesen Prozess zu beschleunigen und die Abbauprodukte der Siloxane besser nachvollziehen zu können, haben Forschende um Tyler Fulton vom California Institute of Technology (Caltech) nun eine neue Technik für den Abbau dieser Verbindungen entwickelt. In Vorarbeiten hatten die Biochemiker bereits ein bakterielles Enzym so weiterentwickelt, dass es solche unnatürlichen Silizium-Kohlenstoff-Bindungen auf biologische und umweltfreundliche Weise herstellen kann.
Daran anknüpfend haben Fulton und seine Kollegen nun ein weiteres bakterielles Enzym so modifiziert und optimiert, dass es den Umkehrprozess durchführen kann: die Bindung wieder aufzubrechen. Beide Enzyme haben die Forschenden durch sogenannte gerichtete Evolution im Labor gezüchtet. Dabei veränderten sie das Enzym-kodierende Gen mehrfach geringfügig, bis die gewünschten Eigenschaften vorhanden waren.
„Bei der gerichteten Evolution evaluieren wir Hunderte neuer Enzyme parallel, um einige Enzymvarianten mit verbesserter Aktivität zu identifizieren“, erklärt Fulton. Diese Varianten wurden dann jeweils ausgewählt und weiter optimiert.
Suche nach Startpunkt in der Natur
Dieser Prozess der Enzymveränderung mittels gerichteter Evolution, der 2018 mit dem Chemie-Nobelpreis ausgezeichnet wurde, ist inzwischen Standard in der Biochemie und Biotechnologie. „Die Herausforderung bestand jedoch darin, das Ausgangsenzym für den gerichteten Evolutionsprozess zu finden, eines mit nur einer winzigen Menge der gewünschten Aktivität“, sagt Seniorautorin und Nobelpreisträgerin Frances Arnold vom Caltech.
Statt wie sonst üblich bei Null anzufangen und auf gut Glück in der Natur nach diesem Startenzym zu suchen, konnten Arnold und ihre Kollegen auch hier auf Vorarbeiten zurückgreifen. „Wir haben ein geeignetes Ausgangsenzym in unserer einzigartigen Sammlung von Cytochrom-P450-Enzymen gefunden, die wir zuvor für andere Arten neuartiger Siliziumchemie angelegt hatten.“
Wie hat das neue Enzym die Bindung geknackt?
Das Ergebnis ist ein verbessertes Enzym, das die Silizium-Kohlenstoff-Bindungen in Siloxanen effektiv abbaut, sodass daraus Silanole entstehen. Das Enzym spaltet dabei die hartnäckige Silizium-Kohlenstoff-Bindung jedoch nicht direkt, sondern nutzt einen Umweg, wie Analysen des Reaktionsmechanismus ergaben. Demnach ersetzt der Biokatalysator in zwei Oxidations-Schritten zwei Kohlenstoff-Wasserstoff-Bindungen der Methylgruppe durch eine Kohlenstoff-Sauerstoff-Doppelbindung. Dadurch bricht die benachbarte Silizium-Kohlenstoff-Bindung leichter auf.
Damit haben die Forschenden erstmals einen natürlichen Katalysator für den Abbau der menschengemachten Siloxane entwickelt. Anders als bei rein chemischen Abbauprozessen funktioniert dieser auch unter milden Bedingungen. Wegen seines bakteriellen Ursprungs kann das optimierte Enzym zudem einfach in Bakterien hergestellt werden. „Die Natur ist eine erstaunliche Chemikerin und zu ihrem Repertoire gehört nun auch das Aufbrechen von Bindungen in Siloxanen, von denen man früher annahm, dass sie dem Angriff lebender Organismen entgehen“, sagt Arnold.
Enzyme könnten Siloxane in Abwasser abbauen
Das neuentwickelte Enzym könnte in einigen Jahren genutzt werden, um Siloxane auch in größerem Maßstab biologisch abzubauen, hoffen die Forschenden. „Beispielsweise könnten weiter verbesserte Versionen von im Labor entwickelten Enzymen wie diesem zur Behandlung von Siloxanverunreinigungen im Abwasser verwendet werden“, sagt Arnold. „Oder es könnten sich natürliche Organismen in siloxanreichen Umgebungen entwickeln, um eine ähnliche Reaktion zu katalysieren.“
Diese Hoffnung basiert auf Beobachtungen, wonach sich in plastikhaltigen Umgebungen Bakterien ansiedelten, die PET abbauen können. Daraus ist ein Forschungstrend zu plastikabbauenden Enzymen entstanden. Ähnliches könnte bei Siloxanen passieren und effektive Enzyme für ihren Abbau hervorbringen, so Arnold. „Wir hoffen, dass unsere Studie weitere Arbeiten zum Abbau von Siloxanverbindungen inspirieren wird“, ergänzt Fulton. (Science, 2024; doi: 10.1126/science.adi5554)
Quelle: California Institute of Technology