Die dreidimensionale Struktur eines menschlichen Enzyms zur Genregulierung und dessen Arbeitsweise in der Zelle hat jetzt ein internationales Wissenschaftlerteam aufgeklärt. Die Forscher berichten über die Ergebnisse ihrer Studie in der aktuellen Online-Ausgabe des Wissenschaftsmagazins Nature.
Das menschliche Erbgut enthält 20.000 bis 30.000 Gene als Informationseinheiten. Diese werden im Verlauf der Entwicklung eines Menschen durch einen als „Genregulation“ bezeichneten Prozess gezielt aktiviert und deaktiviert. Eine zentrale Rolle kommt hierbei speziellen Proteinen, den DNA-Methyltransferasen, zu. Sie können Sequenzen von Genen im Erbgut erkennen und durch so genannte DNA-Methylierung, die Anlagerung von Methylgruppen als Markermolekülen an Schlüsselpositionen, das Ablesen der nachfolgenden Gensequenz und somit ihre Aktivierung verhindern. Störungen dieses Prozesses können zu Entwicklungsdefekten führen und Krankheiten auslösen.
Strukturanalyse bei Proteinen
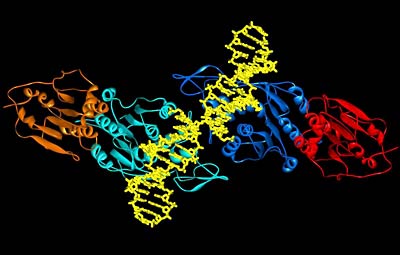
Die Forscher um Professor Albert Jeltsch von der Jacobs University Bremen und Professor Xiaodong Cheng, Experte für Strukturbiologie an der Emory University, USA, klärten jetzt mittels Röntgenkristallographie die räumliche Struktur der menschlichen Proteine Dnmt3a und Dnmt3L, die als Funktionseinheit eine zentrale Rolle bei der Genregulierung durch DNA-Methylierung während der menschlichen Embryonalentwicklung spielen.
Das überraschende Ergebnis der Strukturanalyse war, dass sich jeweils zwei Dnmt3a-Dnmt3L-Einheiten als Dimer aneinanderlagern, so dass eine Methyltransferase mit zwei aktiven Zentren in einem ganz bestimmten räumlichen Abstand entsteht. Funktionelle Untersuchungen zur Bindung des Enzyms an die Ziel-DNA-Sequenz im menschlichen Erbgut zeigten, dass der spezifische räumliche Abstand der beiden aktiven Zentren des Enzyms in der Art eines Schlüssel-Schloss-Prinzips häufig auch auf der Ziel-Sequenz der DNA zu finden war. Methylierungsexperimente konnten darüber hinaus zeigen, dass beide Zentren auch oft gleichzeitig für einen Anlagerung von Methylgruppen an die DNA sorgten.
Von der Eizelle zum Lebewesen
„Die besondere Struktur und Funktionsweise des von uns untersuchten Enzyms zeigt ganz neue Facetten der Methylierung von DNA in menschlichen Zellen. So könnte das neu entdeckte enzymatische ‚Doppelpack‘ zum einen eine spezielle Form von Bindungsspezifität zwischen Enzym und Zielmolekül darstellen. Die parallele Aktivität der beiden Zentren könnte auch dafür sprechen, dass bestimmte Regulierungsprozesse besonders schnell ausgeführt werden müssen“, sagte Jeltsch zu den Ergebnissen der Studie.
Und weiter: „In jedem Fall bringt uns unser Forschungsergebnis dem Verständnis des faszinierenden Vorgangs der organismischen Entwicklung näher, bei dem aus einer befruchteten Eizelle ein komplettes Lebewesen entsteht.“
(idw – Jacobs University Bremen, 24.08.2007 – DLO)