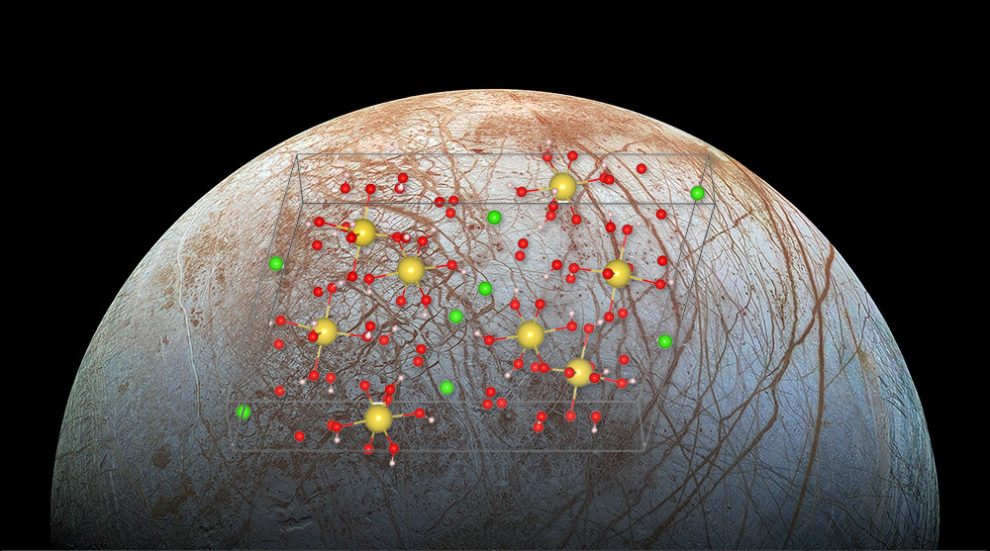
Kochsalz der etwas anderen Art: Chemiker haben drei neue, ungewöhnlich wasserreiche Formen von Kochsalz-Kristallen entdeckt. Bei diesen Salzhydraten kommen bis zu 17 Wassermoleküle auf ein Natriumchloridmolekül, trotzdem sind sie fest. Sie entstehen, wenn Natriumchlorid und Wasser unter hohem Druck heruntergekühlt werden. Diese Hydrate könnten erklären, warum auf Eismonden des Sonnensystems und dem Zwergplanet Ceres zwar Kochsalz nachgewiesen wurde, dieses aber zu keiner der bekannten Kristallformen des Natriumchlorids passt.
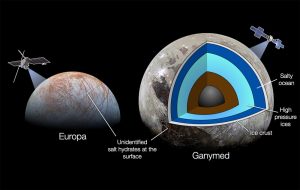
Salz ist in unserem Sonnensystem allgegenwärtig: Es prägt nicht nur die Ozean der Erde, sondern wahrscheinlich auch die subglazialen Ozeane von Eismonden wie Europa, Enceladus oder Ganymed. Messdaten von Raumsonden belegen zudem, dass Natriumchlorid auch auf der Oberfläche dieser Himmelskörper vorhanden ist: Das Kochsalz färbt beispielsweise die Oberfläche des Jupitermonds Europa gelblich und erzeugt weiße Flecken auf dem Zwergplaneten Ceres.
Woraus besteht das salzige Eis?
Das Merkwürdige jedoch: Die spektrale Signatur dieser eisigen Kochsalzvorkommen passt zu keiner der bisher bekannten Kristallformen des Natriumchlorids. Es entspricht weder der kompakten Struktur des reinen Kochsalzkristalls noch der des Natriumchlorid-Dihydrats (NaCl·2H2O), bei dem auf jedes Kochsalz-Molekül zwei Wassermoleküle kommen. „Das Verhalten von Salz und Wasser unter irdischen Bedingungen ist gut bekannt. Aber bei allem, was darüber hinaus geht, tappen wir völlig im Dunkeln“, sagt Baptiste Journaux von der University of Washington.
In welcher Form das Kochsalz auf den eisigen Himmelskörpern des Sonnensystems vorliegt, ist daher ein ungelöstes Rätsel. Um mehr Licht in die Sache zu bringen, haben Journaux und sein Team nun untersucht, was mit Kochsalz passiert, wenn man es in Gegenwart von Wasser den Bedingungen aussetzt, wie sie in den eisigen Krusten von Europa, Ceres und Co vorkommen.
Neuartige Kristallstrukturen
Dafür platzierten die Forschenden Proben von Natriumchlorid und Wasser in einer Diamantstempelzelle und setzten es Drücken von bis zu 2.500 Megapascal aus. Dabei variierten sie die Temperatur von Raumtemperatur bis zu minus 125 Grad. Um die Kristallstruktur der dabei entstehenden Kristalle sichtbar zu machen, analysierten die Forschenden ihre Proben mittels Raman-Spektroskopie und Röntgenbeugung im Strahlgang des Deutschen Elektronensynchrotrons DESY in Hamburg und an der europäischen Röntgenquelle ESRF in Grenoble.
Das überraschende Ergebnis: Bei Abkühlung unter erhöhtem Druck entstanden gleich drei zuvor unbekannte Varianten des Kochsalzhydrats. Statt des bisher bekannten Dihydrats entwickelten sich neuartige Salzhydrate mit einem weit größeren Wasseranteil in ihrer Kristallstruktur. „Als wir den Druck erhöhten, sahen wir, wie diese unerwarteten Kristallformen zu wachsen begannen“, berichtet Journaux.
SC8.5: An der Oberfläche der Eismonde stabil
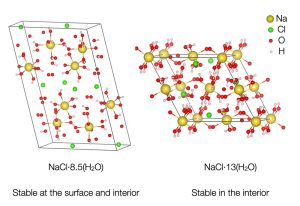
Die erste Hydratform, SC8.5 (2NaCl·17H2O), entsteht bei Temperaturen unterhalb von minus 38 Grad und einem Druck zwischen 300 und 700 Megapascal. „Die Bildung von SC8.5 könnte bei den Eismonden demnach in den oberen Kilometern der Eishülle stattfinden“, erklären die Forschenden. Bei diesem Kochsalzhydrat kommen 17 Wassermoleküle auf zwei Natriumchlorid-Moleküle. Dabei bilden Natriumionen und Wasser im Kristall eine Schicht aus Oktaedern, dazwischen liegt jeweils eine dünne Schicht Chloridionen.
Das Besondere am neuentdeckten Salzhydrat SC8.5: Wenn sich diese Kristallstruktur einmal gebildet hat, bleibt sie auch dann stabil, wenn der Druck wieder auf normale Werte absinkt. Solange die Temperaturen unterhalb von minus 50 Grad bleiben, bleibt auch dass wasserreiche Salzhydrat SC8.5 bestehen. „SC8.5 könnte demnach auch an der Oberfläche der Eismonde stabil bleiben“, so Journaux und seine Kollegen. „Das ist genau die Struktur, auf die wir gewartet haben, um das Salzeis auf den Oberflächen zu erklären.“
SC13: Salzhydrat im Eismantel von Ganymed und Co
Das zweite neuentdeckte Salzhydrat ist SC13 (NaCl·13H2O). In seiner Kristallstruktur bilden die Chloridionen keine eigenen Schichten, sondern sind zusammen mit dem Wasser relativ gleichmäßig im Gitter verteilt. Insgesamt kommen dabei 17 Wassermoleküle auf ein Natriumchloridmolekül. Das SC13-Salzhydrart entsteht bei einem Druck von 1.500 Megapascal schon ab minus drei Grad. Dieses Salzeis könnte daher im Manteleis von Ganymed, Callisto oder auch dem Titan vorkommen, aber auch am Unterrand der Eiskrusten von Monden mit einem subglazialen Ozean.
Ein drittes, besonders dichtes Salzhydrat tritt bei Drücken von rund 500 Megapascal auf und bildet nadelähnliche Kristalle. Auch dieses Salzeis ist wasserreicher als das Kochsalz-Dihydrat. Seine genaue Kristallstruktur konnte das Team jedoch noch nicht bestimmen. „Diese neuen Phasen sind faszinierend, weil sie eine unerwartete Vielfalt von Wasser/Salz-Kristallstrukturen bei hohem Druck und niedriger Temperatur zeigen“, sagt Journaux.
Phasendiagramm muss erweitert werden
Nach Ansicht der Wissenschaftler könnten ihre neuentdeckten Salzhydrate erklären, warum das auf Europa, Ceres und Co beobachtete salzige Eis nicht ins gängige Schema passt: Die dortige Mischung aus Kochsalz und Wasser lässt Kristallformen entstehen, die wir von der Erde nicht kennen und die daher zuvor nicht zugeordnet werden konnten. Journaux und seine Kollegen vermuten zudem, dass die von ihnen identifizierten Kochsalzhydrate erst der Anfang sind. Wahrscheinlich gibt es noch weitere unentdeckte Salzeis-Varianten.
„Die Entdeckung von stabilen Hydraten im Natriumchlorid-Wasser-System erfordert eine Anpassung des Phasendiagramms, das seit der Entdeckung des Natriumchlorid-Dihydrats im Jahr 1847 nicht mehr signifikant geändert worden ist“, konstatieren die Forschenden. (Proceedings of the National Academy of Sciences, 2023; doi: 10.1073/pnas.2217125120)
Quelle: PNAS, University of Washington, Deutsches Elektronensynchrotron DESY