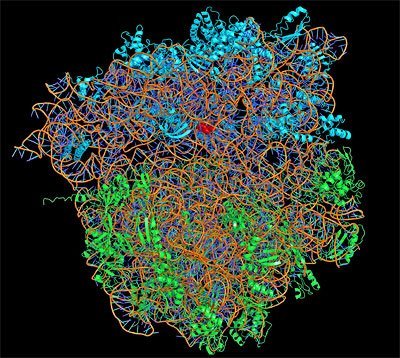
Der diesjährige Chemie-Nobelpreis geht an drei Wissenschaftler, die Struktur und Funktion der Proteinfabrik der Zelle, des Ribosoms, entschlüsselten. In ihm werden die Informationen des Erbguts in Proteine übersetzt und damit erst umsetzbar gemacht. Venkatraman Ramakrishnan, Thomas A. Steitz und Ada E. Yonath eröffneten mit Hilfe der Röntgenkristallographie die entscheidenden Einblicke in dieses Zellorganell.
Jede Zelle unseres Körpers enthält DNA-Moleküle, die Träger des Erbguts. Sie bestimmen, wie unsere Zellen, Gewebe und Organe sich entwickeln. Aber das DNA-Molekül allein ist passiv, nur mit ihm wären wir nicht lebensfähig. Entscheidend ist eine Maschinierie in den Zellen, die aus dieser Blaupause voller Informationen konkrete Werkzeuge des Stoffwechsels, die Proteine, herstellt: das Ribosom. In ihm werden Kopien der DNA-Sequenz, die messenger-RNAs abgelesen und Aminosäure für Aminosäure in das jeweils kodierte Protein übersetzt.
Die so entstehenden Proteine bilden die Basis für unsere Existenz, sei es als Sauerstoff-transportierendes Hämoglobin im Blut, als Antikörper unseres Immunsystems, als Hormon oder Enyzm oder aber als Kollagen in unserer Haut. Um jedoch diese Proteinbildung und auch viele Krankheiten zu vestehen und beklämpfen zu können, ist eine genaue Kenntnis der Vorgänge im Ribosom entscheidend. Und genau dazu trugen die diesjährigen Nobelpreisträger bei.
Der mühsame Weg zum perfekten Kristall
Ada Yonath, heute am Weizmann Institute of Science in Rehovot, Israel, begann schon in den 1960er Jahren an der Möglkichkeit zu arbeiten, die Struktur des Ribosoms mittels der Röntgenkristallographie abzubilden. Bei diesem Verfahren wird eine Probe kristallisert und mit Röntgenstrahlen beschossen. Die Kristalle absorbieren und streuen die Strahlen unterschiedlich stark, eine Fotoplatte hinter der Probe registriert diese Veränderungen.
Der Haken an der Sache: Damit dies fuktioniert, müssen die untersuchten Materialien in möglichst reine und große Kristalle umgewanddelt werden. Angesichts der komplexen Strutur des Ribosoms keine leichte Aufgabe. Fast 20 Jahre lang experimenterte Yonath mit unterschiedlichen Zellen, Temperaturen und Kristallisierungsmethoden, bis sie schließlich nach und nach immer bessere Aufnahmen erhielt. Deutlich waren die schwarzen Punkte, die die Lage von Atomen markierten, zu erkennen. Doch es gab noch ein Problem: Um die Atome und ihre Struktur entziffern zu können, musste bekannt sein, in welchem Winkel genau jeder Punkt das Röntgenlicht abgelenkt hatte.
Hilfe vom Elektronenmikroskop
Die üblichen Verfahren, um dieses Phasenproblem zu lösen, scheiterten an der Komplexität des Ribosoms. Hier jedoch kam Yonath der zweite Preisträger zu Hilfe: Thomas Steitz, heute an der Yale Universität in New Haven, USA, nutzte elektronenmikroskopische Bilder des Ribosoms, um zumindest grob die Orientierung und Position der Ribosomen im Kristall zuzuordnen. Zusammen mit den kristallographischen Aufnahmen gelang es ihm, daraus den Phasenwinkel zu ermitteln – und damit den Weg frei zu machen für die ersten Strukturmodelle des Ribosoms.
1998 veröffentlichte Steitz seine erste Kristallstruktur, zunächst der größeren Untereinheit des Ribosoms. Noch konnte man in der verschwommenen Aufnahme keine Atome erkennen, aber immerhin schon die Lage der RNA-Moleküle im Inneren.
Beide Untereinheiten Atom für Atom
Zwei Jahre später, im Jahr 2000, aber war es Steitz dann gelungen, die Struktur dieser Untereinheit in fast atomarer Auflösung zu ermitteln. Yonath und der dritte Preisträger, Venkatraman Ramakrishnan vom MRC Laboratorium für Molekularbiologie in Cambridge, Großbritannien, ermittelten das gleiche für die kleinere Untereinheit. Gemeinsam eröffneten die drei Preisträger damit erstmals einem Einblick in die fazinierende Arbeit der Proteinfabrik der Zelle, zeigten, wie genau die RNA in Proteine übersetzt wird.
Gleichzeitig schufen die Wissenschaftler auch die Voraussetzung dafür, neue Ansatzstellen für den Kampf gegen bakterielle Krankheitserreger zu gewinnen. Denn die von ihnen generierten 3D-Modelle zeigen, wie verschiedene Antibiotika an die bakteriellen Ribosomen binden und so deren Funktion beeinträchtigen. Die Modelle ermölichen es damit auch, neue Antibiotika für diese Bindungsstellen quasi maßzuschneidern
(Nobel Komitee, 07.10.2009 – NPO)