Lange galten das Atom und insbesondere sein Kern als kleinste, nicht weiter zerlegbare Einheit aller Dinge: „Atomos“ – das Unteilbare. Doch inzwischen ist klar, dass der Atomkern kein Monolith, sondern aus noch kleineren Teilchen zusammengesetzt ist.
Protonen, Neutronen und die Isotope
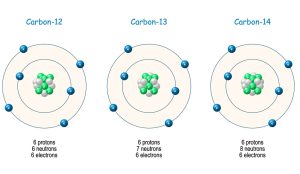
Die erste Ebene der Kernbausteine bilden die Nukleonen – positiv geladene Protonen und nicht geladene Neutronen. Beide haben etwa die gleiche Masse und prägen zusammen das Atomgewicht. Die Zahl der Protonen im Kern – auch Kernladungszahl genannt – bestimmt, wie viele Elektronen ein Atomkern an sich binden kann und zu welchem Element im Periodensystem das Atom gehört. Die Spanne reicht momentan vom leichten Wasserstoff mit nur einem Proton bis zum Organesson mit 118 Protonen – dem bisher schwersten bekannten Element.
Doch nicht jeder Atomkern innerhalb eines Elements ist identisch: Bei gleicher Protonenzahl kann die Menge der Neutronen im Atomkern variieren, diese Varianten werden als Isotope bezeichnet. Beim Kohlenstoff beispielsweise haben 98,9 Prozent aller Atome sechs Protonen und sechs Neutronen im Kern. Bei 1,1 Prozent des Kohlenstoffs kommt jedoch ein siebtes Neutron dazu und bildet das Kohlenstoff-Isotop 13C. Jedes Milliardste Kohlenstoffatom hat sogar noch ein achtes Neutron. Je nach Nukleonenzahl kann ein Isotop entweder dauerhaft stabil sein oder aber nach einiger Zeit zerfallen. Während 12C und 13C stabil sind, liegt die Halbwertszeit bei 14C bei rund 5.700 Jahren.
Hat der Atomkern eine Struktur?
So weit, so bekannt. Doch wie sieht es im Inneren eines Atomkerns aus? Bilden die Nukleonen einfach nur einen ungeordneten massiven Klumpen? Oder gibt es möglicherweise eine innere Struktur? Bisher ist diese Frage nicht eindeutig beantwortet – es gibt aber Indizien für Letzteres. So beobachteten Wissenschaftler schon in den 1950er Jahren, dass Atomkerne mit einer bestimmten Zahl von Kernbausteinen stabiler sind als andere. Tragen sie eine solche „magische Zahl“ von Protonen oder Neutronen in sich, zerfallen radioaktive Isotope später und stabile Atomkerne benötigen mehr Energie, um Nukleonen abzugeben.
Ausgehend von diesen Beobachtungen vermuten Kernphysiker, dass es im Atomkern quantenmechanisch bedingte „Schalen“ gibt, die von den Protonen und Neutronen sukzessive aufgefüllt werden – ähnlich wie die Orbitale der Elektronen in der Atomhülle. Analog zu diesen könnten volle Kernschalen energetisch vorteilhaft sein und dem Atomkern eine größere Stabilität verleihen. Bisherigen Erkenntnissen zufolge liegen die stabilen, vollen Schalen des Atomkerns bei 2, 8, 20, 28, 50 und 82 Protonen, bei Neutronen sind die „magischen Zahlen“ die gleichen.
Magische Zahlen
Diese „Magie“ der vollen Kernschalen zeigt sich beispielsweise bei den Elementen Helium, Sauerstoff, Calcium, Nickel, Zinn und Blei. Sie sind wegen ihrer „magischen Zahl“ von Protonen besonders stabil und besitzen vergleichsweise viele stabile Isotope – beim Zinn sind es gleich zehn. Um dieses Phänomen zu illustrieren, haben Forscher im Jahr 2020 erstmals ein Periodensystem zusammengestellt, in dem sie die Elemente nach der Füllung ihrer Kernschalen gruppierten – es zeigt die bekannten Elemente in einem ganz neuen Licht.
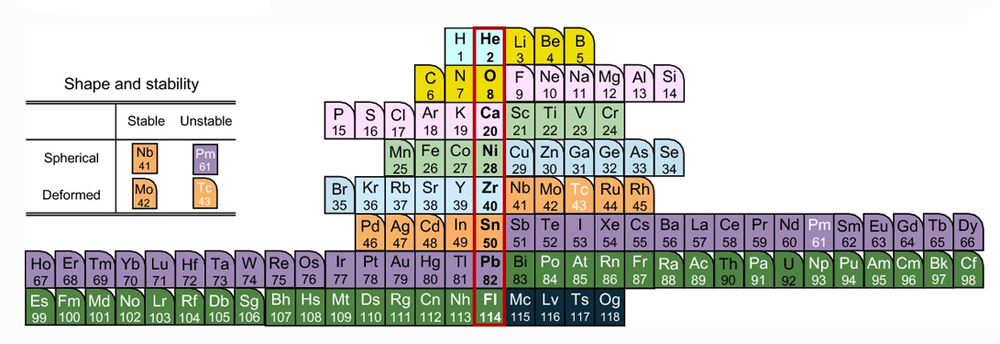
Innerhalb dieser Elemente gibt zudem Isotope, die „doppelt magisch“ sind: Sie haben sowohl bei den Protonen wie bei den Neutronen eine volle Kernschale. Dazu gehören beispielsweise die Isotope Helium-4, Sauerstoff-16 und Calcium-40. Sie weisen jeweils bei Protonen und Neutronen die magischen Zahlen 2,8 und 20 auf und bilden den größten und stabilsten Anteil dieser Elemente.
Zwischen Kugel und Rugbyball
Interessant auch: Ob ein Atomkern eine „magische Zahl“ von Nukleonen in sich trägt, kann man ihm sogar äußerlich ansehen. Denn solche Kerne sind im Grundzustand fast perfekt kugelförmig. Bei Elementen mit nur halb gefüllten Kernschalen ist der Atomkern dagegen deformiert: Er ist selbst im Grundzustand leicht elliptisch und ähnelt eher einem Rugby-Ball als einer Kugel. Dies ist beispielsweise bei Magnesium oder Kupfer der Fall.
Ein Extrembeispiel für den Formwandel des Atomkerns ist das Element Quecksilber: Bei schweren Isotopen mit 100 bis 106 Neutronen wechselt der Kern mit steigender Neutronenzahl sprunghaft seine Form – von der kompakten Kugel zum großen, ovalen Rugbyball und zurück, wie Kernphysiker im Jahr 2018 herausfanden. Insgesamt sechs solcher Phasenwechsel beobachteten sie in der Isotopenkette des Quecksilbers. Ein solches Verhalten ist von keinem anderen Element bekannt.
Auch diese verblüffende Eigenheit des Quecksilbers führen Physiker auf die quantenmechanischen Kernorbitale zurück: Bei diesen anomalen Isotopen bilden vier Protonen und acht Neutronen des Kerns offenbar einen angeregten Komplex, der zu einer speziellen Besetzung der Kernorbitale führt – und den Atomkern gewissermaßen aufbläht. Doch was verraten all diese Erkenntnisse und Beobachtungen über das Verhalten der Kernbausteine?







