Erstaunlich nah am Original: Forscher haben erstmals Gehirne im Labor gezüchtet, die komplexe Hirnwellen zeigen – sie erzeugen Hirnstromsignale wie ein echtes Gehirn. Die Aktivitätsmuster dieser aus Stammzellen gewachsenen Mini-Denkorgane ähneln dabei zum Teil denen frühgeborener Babys. Dies spricht dafür, dass die Retortengehirne nicht nur anatomisch dem echten Gehirn gleichen, sondern dass sie auch die hirntypischen funktionellen Netzwerke ausbilden können.
Die Entwicklung und Funktionsweise des menschlichen Gehirns ist bis heute erst in Teilen verstanden. Mit Tiermodellen und Hirnscans allein können Forscher die Geheimnisse dieses komplexen wie faszinierenden Denkorgans wohl nie vollumfänglich lüften. Deshalb suchen sie schon länger nach Möglichkeiten, menschliche Gehirne mithilfe von Stammzellen im Reagenzglas wachsen zu lassen.
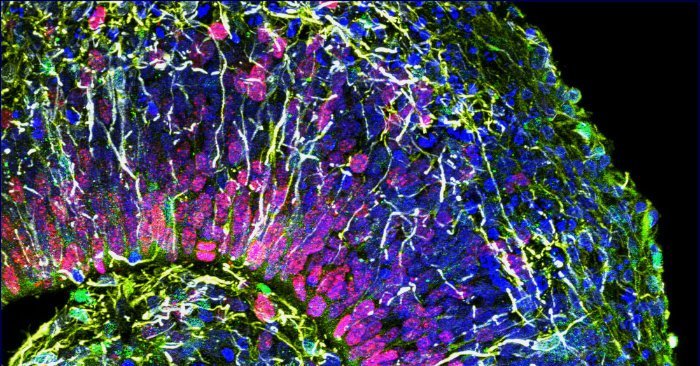
Die Nachbildungen neuronalen Gewebes sind in den vergangenen Jahren immer komplexer geworden. Mittlerweile können im Labor „Mini-Gehirne“ entstehen, die ähnliche zelluläre Strukturen aufweisen wie das Original und deren Zellen sogar miteinander kommunizieren. Allerdings: Keines dieser sogenannten Organoide hat bisher funktionelle Netzwerke ausgebildet wie sie von unserem Gehirn bekannt sind. Genau diese komplexen Verknüpfungen von Neuronen sind für die meisten Hirnaktivitäten jedoch entscheidend.
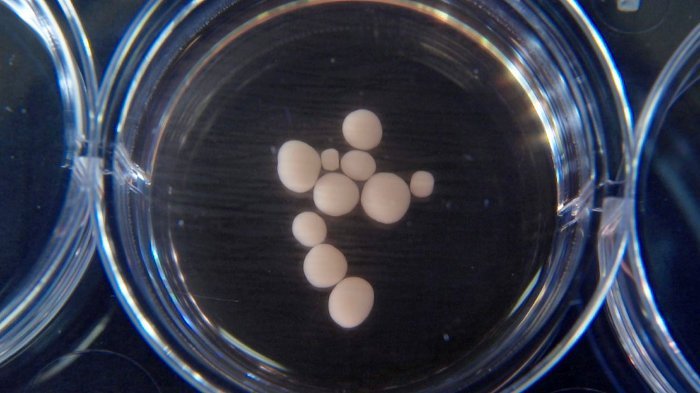
Erbsengroße Organoide
Umso spannender ist daher das, was nun Forschern um Cleber Trujillo von der University of California in San Diego gelungen ist: Sie haben erstmals Retortengehirne in einem frühen Entwicklungsstadium gezüchtet, die funktionelle Netzwerke entwickelt haben. Die erbsengroßen „Mini-Gehirne“ wuchsen wie ihre Vorgänger aus induzierten pluripotenten Stammzellen, die das Team aus Hautzellen gewonnen hatte.
Gibt man diese reprogrammierten Zellen in ein spezielles Kultursystem, bilden sie nach und nach hirntypische Zelltypen und Strukturen aus. Trujillo und seine Kollegen optimierten für ihre Studie unter anderem diese Umgebung. Sie veränderten die Zusammensetzung des Nährmediums sowie die zeitliche Abfolge, in der bestimmte Faktoren zu der Kultur hinzugegeben werden. Dank dieser Anpassungen entwickelten sich ihre Organoide weiter als frühere Modelle und erreichten ein höheres Reifestadium mit mehr Zellvielfalt.
Die ersten Hirnwellen
Doch würden sich diese Fortschritte auch in der Hirnaktivität widerspiegeln? Um dies herauszufinden, ließen die Wissenschaftler hunderte von „Mini-Gehirnen“ zehn Monate lang wachsen. Dabei überwachten sie kontinuierlich die elektrischen Signale, die von ihren Organoiden ausgingen.
Das Ergebnis: Nach zwei Monaten bemerkten die Forscher die ersten Hirnwellen. Diese Signale waren noch selten und wurden immer wieder von Pausen ohne Aktivität unterbrochen – genauso wie es von frühen menschlichen Gehirnen bekannt ist. Im Laufe der Hirnentwicklung werden diese stillen Phasen normalerweise immer kürzer, bis das Gehirn kontinuierlich ausgeprägte Aktivitätsmuster zeigt.
Immer komplexer
Genau das passierte auch bei den Nachbildungen im Labor, wie Trujillos Team berichtet: Die Organoide produzierten Hirnwellen unterschiedlicher Frequenzen und die vom Elektroenzephalogramm (EEG) registrierten Signale wurden regelmäßiger und häufiger – ein Zeichen dafür, dass sich mehr funktionelle Verknüpfungen ausgebildet hatten.
„Wir konnten es erst gar nicht glauben und dachten, unsere Elektroden wären kaputt“, sagt Trujillos Kollege Alysson Muotri. Doch weitere Untersuchungen bestätigten: Die Retortengehirne schienen tatsächlich Netzwerke neuronaler Verknüpfungen entwickelt zu haben.
Ähnlichkeit mit Baby-Gehirnen
Wie sehr diese funktionellen Neuronennetze dem menschlichen Vorbild ähnelten, zeigten Vergleiche mit den EEG-Daten von unterschiedlich weit entwickelten Frühchen. Die Wissenschaftler trainierten einen intelligenten Algorithmus mit diesen Informationen und konfrontierten das Programm anschließend mit den Hirnwellenaufzeichnungen der Organoide.
Das Frappierende: Der Algorithmus konnte anhand dieser Daten erstaunlich gut vorhersagen, wie viele Wochen die „Mini-Gehirne“ im Kultursystem gewachsen waren. Die Miniatur-Nachbildungen schienen sich demnach zumindest zum Teil ähnlich zu entwickeln wie die Gehirne der Babys, wie das Forscherteam erklärt.
Noch weit entfernt vom Denken
„Das Maß an neuronaler Aktivität, das wir in unseren Organoiden sehen, ist in vitro bisher noch nie dagewesen“, konstatiert Muotri. „Wir sind damit einen Schritt näher an einem Modell, das tatsächlich komplexe Hirn-Netzwerke in frühen Stadien abbilden kann.“ In Zukunft könnten die Organoide dabei helfen, Leiden wie Epilepsie, Autismus oder Schizophrenie zu erforschen – Erkrankungen, die mit Fehlfunktionen von Hirnnetzen in Verbindung gebracht werden.
Eines aber ist trotz all der Fortschritte klar: Bewusst denken wie wir können die „Mini-Gehirne“ noch lange nicht. „Das Organoid ist noch immer ein sehr rudimentäres Modell“, betont Muotri. „Es funktioniert längst nicht so wie ein vollständiger Cortex, selbst eines Babys.“ Aus diesem Grund können die Retortengehirne bisher auch nicht in jedem Fall die Forschung mit echtem Hirngewebe ersetzen. „Aber sie sind eine potentielle Alternative“, schließt Muotri. (Cell Stem Cell, 2019; doi: 10.1016/j.stem.2019.08.002)
Quelle: Cell Press/ University of California San Diego