Modelle lagen falsch: Die Meeresoberfläche und andere Grenzflächen zwischen Luft und Salzwasser sind anders aufgebaut als gedacht. Denn an ihrer Oberfläche bildet sich keine Doppelschicht aus Ionen der gelösten Salze, wie neue Analysen enthüllen. Stattdessen besteht die oberste Grenzschicht aus reinem Wasser. Erst darunter finden sich auch die Ionen der gelösten Salze, wie die Chemiker in „Nature Chemistry“ berichten. Dies wirft ein neues Licht auf den Aufbau dieser für Ozean, Atmosphäre und Klima so wichtigen Grenzzone.
Gut 70 Prozent unseres Planeten sind von Ozeanen bedeckt – entsprechend groß ist die Kontaktfläche zwischen Salzwasser und Luft. Der hier stattfindende Austausch von Gasen und Energie prägt die Chemie der Meere, aber auch die Erdatmosphäre und das Klima. Umso wichtiger ist es, zu verstehen, wie genau diese Grenzschicht beschaffen ist und welche Moleküle dort den Austausch beeinflussen. Klar ist, dass das Meerwasser aus einem komplexen Gemisch von Wassermolekülen und den Ionen von gelösten Salzen besteht.
Das gängige Modell: Eine Doppelschicht aus Ionen
Das Problem jedoch: Wie die Grenzschicht zwischen Salzwasser und Luft strukturiert ist, ist bisher nur in Teilen geklärt. Denn Analysen mittels Spektroskopie und molekularen Modellsimulationen liefern kein eindeutiges Bild. Generell ging man aber davon aus, dass sich die Ionen der gelösten Salze an der Grenzschicht zur Luft anreichern. Dabei bilden schwere, gut polarisierbare Ionen wie die negativ geladenen Brom- und Iod-Anionen eine Art Deckschicht. Leichtere, wenig gut polarisierbare Ionen beispielsweise von Natrium oder Fluor sinken dagegen ab.
„Gängiger Vorstellung nach erzeugt diese unterschiedliche Verteilung der Anionen und Kationen die sogenannte Elektrische Doppelschicht (EDL) – eine ionische Doppelschichtstruktur“, erklären Yair Litman vom Max-Planck-Institut für Polymerforschung in Mainz und seine Kollegen. Diese in vielen Lehrbüchern beschriebene Grenzschicht beeinflusst die Prozesse an der Luft-Salzwasser-Kontaktfläche fundamental – so die Annahme. Doch in jüngster Zeit haben einige Messungen Zweifel an diesem Doppelschichtmodell geweckt.
Neue Methode enthüllt Molekülausrichtung
Deshalb haben nun Litman und sein Team eine neue Methode entwickelt, um das Verhalten der Wassermoleküle und Ionen an der Salzwasser-Luft-Grenzfläche zu analysieren. Ihr Verfahren basiert auf der spektroskopischen Technik der sogenannten Vibrations-Summenfrequenz-Erzeugung (Vibrational Sum-Frequency Generation, VSFG). Dabei werden Laserstrahlen genutzt, um die Wassermoleküle zu Schwingungen anzuregen und ihre Position zu bestimmen. Die Ionen der gelösten Salze ließen sich damit jedoch nicht direkt beobachten.
Für ihre Studie ergänzten die Chemiker das VSFG-Verfahren um eine Methode, die auch die Richtung der spektroskopischen Signale anzeigt. Diese Heterodyne Detected VSFG liefert unter anderem Aufschluss darüber, wie die Wassermoleküle ausgerichtet sind. Litman und seine Kollegen nutzten dies, um die Grenzschicht von zehn verschiedenen Salzlösungen zu untersuchen.
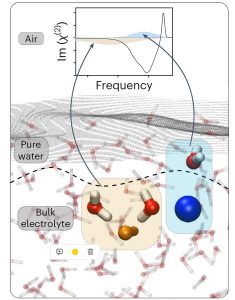
Reines Wasser statt ionischer Doppellage
Die Analysen enthüllten Überraschendes: „Unsere Arbeit zeigt, dass die Oberfläche von einfachen Elektrolytlösungen eine andere Ionenverteilung aufweist als bisher angenommen“, berichtet Litman. Entgegen den gängigen Modellen gibt es demnach beim Salzwasser keine ionische Doppelschicht an der Grenzfläche zur Luft. Stattdessen zeigte das Schwingungsspektrum einen Peak, der von den O-H-Bindungen der Wassermoleküle herrührt.
Das bedeutet: „Wenn man von der Luft in die Salzlösung eintritt, trifft man zunächst auf einige Schichten reinen Wassers“, erklärt Litman. In dieser liegen die Wassermoleküle in verschiedenen Ausrichtungen vor, ihre Sauerstoffseite zeigt dabei mal nach oben, mal nach unten. „Erst darunter folgt eine ionenreiche Schicht, bevor man die Hauptflüssigkeit erreicht“, so Litman weiter. Diese gelösten Ionen bilden jedoch bei den meisten Salzen, darunter Natriumchlorid, Natriumfluorid, Magnesiumchlorid oder Magnesiumsulfat, keine Elektrische Doppelschicht.
Nur beim Natriumperchlorat (NaClO4) konnten die Chemiker dessen Ionen direkt an der Wasseroberfläche nachweisen. „Dieses Salz bildet somit in der Tat eine EDL“, so das Team.
Anders als das Lehrbuchmodell
Zusammengenommen zeigen diese Ergebnisse, dass das gängige Modell der ionischen Doppelschicht in vielen Fällen nicht zutrifft. Zwar bildet sich an der Grenzfläche von Salzwasser zu Luft eine Schichtstruktur aus. Diese ist jedoch bei den meisten Salzlösungen anders aufgebaut als die EDL. Damit müssen nicht nur gängige Lehrbuch-Beschreibungen angepasst werden. Die neuen Erkenntnisse sind auch wichtig für das Verständnis der Vorgänge an der Grenze zwischen Luft und Meer und für die Atmosphärenchemie.
„Die Schichtung und die in unserer Arbeit demonstrierten Wasser-Ionen-Interaktionen liefern damit wichtige Einblicke in das Rätsel der Wasser-Luft-Grenze und die chemische Reaktivität dieser allgegenwärtigen Kontaktfläche“, konstatieren die Chemiker. Zudem können die Ergebnisse und die neuentwickelte Methodik dabei helfen, Flüssigkeitsgrenzflächen auf molekularer Ebene genauer zu erforschen. (Nature Chemistry, 2024; doi: 10.1038/s41557-023-01416-6)
Quelle: Max-Planck-Institut für Polymerforschung













