Verborgener Effekt: Wenn wir vom Coronavirus oder einem anderen Erreger infiziert sind, greifen diese auch die Kraftwerke unserer Zellen an – die Mitochondrien. Wie Forscher am Beispiel des Toxoplasmose-Erregers beobachtet haben, kommt es schon wenige Stunden nach Infektion zur Ablösung großer Teile der äußeren Mitochondrien-Membran. Ursache dafür ist eine Stressreaktion der Zellkraftwerke: Sie versuchen sich auf diese Weise zu schützen, schaden sich aber nur selbst, wie das Team in „Science“ berichtet.
Mitochondrien sind die Kraftwerke und Akkus unserer Zellen. Sie produzieren den chemischen Energieträger unseres Stoffwechsels in Form des Moleküls Adenosintriphosphat (ATP) und sind daher entscheidend für die Funktion aller Zellen, Gewebe und Organe. In ihrem Inneren sind die Mitochondrien dafür in viele, unabhängig voneinander funktionierende Untereinheiten gegliedert, die ständig flexibel ihre Form ändern. Ihre äußere Membran dient hingegen dem Austausch mit der zellulären Umgebung.
Blick in die infizierte Zelle
Was aber passiert, wenn eine Zelle von einem Erreger befallen wird – sei es einem Bakterium, einem einzelligen Parasiten oder einem Virus wie dem Coronavirus SARS-CoV-2? Bekannt ist, dass vor allem die Viren die Zellbestandteile drastisch umbauen, um ihre Vermehrung zu optimieren. Dagegen werden die Mitochondrien aktiv, indem sie Immunreaktionen auslösen und Krankheitserregern die Nährstoffe entziehen, die diese für ihr Wachstum benötigen.
Welche Folgen diese Konfrontation für die Zellkraftwerke hat, haben nun Xianhe Li vom Max-Planck-Institut für Biologie des Alterns in Köln und seine Kollegen näher untersucht. „Wir wollten wissen, wie sich das Verhalten der Mitochondrien sonst noch verändert, wenn Mitochondrien und Krankheitserreger in der Zelle aufeinandertreffen. Da die äußere Membran dieser Organellen der erste Kontaktpunkt mit den Eindringlingen ist, haben wir uns diese genauer angeschaut“, erklärt Seniorautorin und Lis Kollegin Lena Pernas.
Mitochondrien geben große „Blobs“ ab
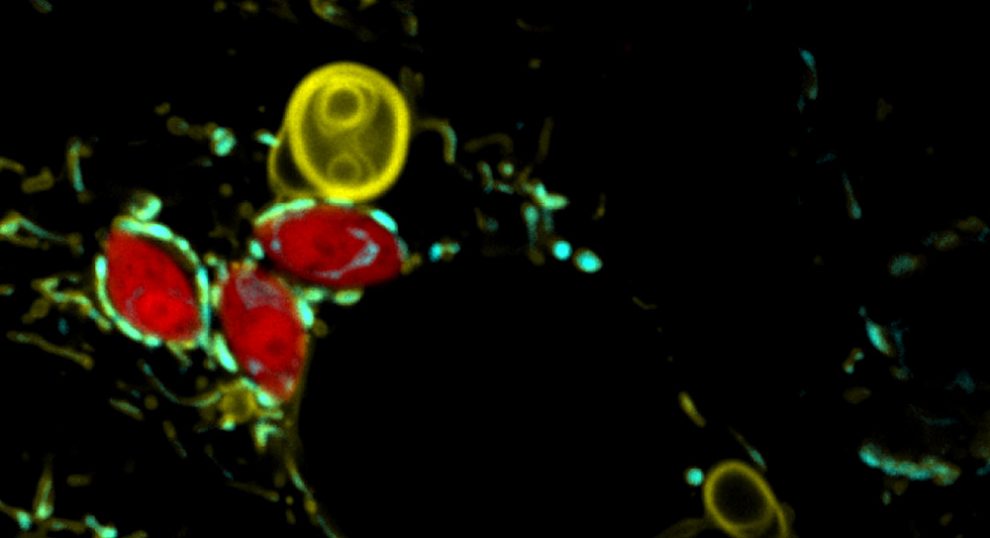
Für ihre Studie infizierte das Forschungsteam mit Fluoreszenzproteinen markierte Mäusezellen mit dem einzelligen Parasiten Toxoplasma gondii, dem Erreger der Toxoplasmose. Unter dem Mikroskop beobachten sie anschließend, was mit den Mitochondrien passierte. „Wir sahen, dass Mitochondrien, die mit dem Parasiten in Kontakt kamen, große Strukturen von ihrer äußeren Membran ablösten“, berichtet Li. Schon sechs Stunden noch der Infektion wurden diese abgelösten Lappen als große, elliptische Strukturen in den Zellen sichtbar.
Doch worum handelte es sich? „Der große Durchmesser und das Fehlen von mitochondrialen Matrixproteinen in diesen Strukturen legte nahe, dass es sich nicht um Fragmente ganzer Mitochondrien handelte und auch nicht um die Blasen, die Mitochondrien normalerweise in Reaktion auf Gifte und oxidativen Stress bilden“, erklärt das Team. „Stattdessen handelt es sich um andere, unabhängig davon gebildete Strukturen, die von der äußeren Mitochondrienmembran abgegeben werden.“
Mitochondriales Abwehrsystem blockiert
Nähere Analysen ergaben, dass der Erreger ein Protein produziert, das an einen Rezeptor der äußeren Mitochondrienmembran bindet. Dies führt dazu, dass mehrere Proteine des Zellkraftwerks in ihrer Funktion verändert werden und dadurch dessen Erregerabwehr unterbunden wird, wie die Forschenden herausfanden. „Der Parasit kapert eine normale Reaktion des Wirts auf mitochondrialen Stress. Dies führt zu einer Entwaffnung der Mitochondrien“, erklärt Pernas.
Auf ähnliche Weise könnten auch andere Erreger wie das Coronavirus SARS-CoV-2 die intrazelluläre Abwehrreaktion der Mitochondrien aushebeln. „Andere Forschende haben gezeigt, dass ein Protein des SARS-CoV-2-Virus ebenfalls an diesen Transportrezeptor bindet“, so die Forscherin. „Es sind jedoch weitere Untersuchungen erforderlich, um seine Rolle bei verschiedenen Infektionen besser zu verstehen.“ (Science, 2022; doi: 10.1126/science.abi4343)
Quelle: Max-Planck-Institut für Biologie des Alterns