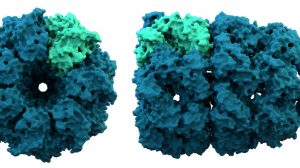
Die Faltung eines Proteins beginnt mit einfachen Bindungen der Wasserstoffatome im Proteinrückgrat und wird schnell kompliziert, wenn es um die Interaktion von Seitenketten der Aminosäuren geht. Doch das Verständnis dieser grundlegenden Mechanismen ist wichtig um die Relevanz einer korrekten Faltung nachvollziehen zu können.
Von der DNA zum funktionstüchtigen Protein
Für die Herstellung eines Proteins wird zunächst der Abschnitt der DNA, der für ein bestimmtes Protein codiert, im Zellkern unserer menschlichen Zellen von der DNA-Polymerase abgelesen und in mRNA umgeschrieben. Diese Messenger-RNA ist eine Kopie der DNA, welche die Information der Bauanleitung für die Proteine aus dem Zellkern in das Zellplasma transportiert. Im Zellplasma warten schon die Ribosomen, welche die mRNA auslesen und entsprechend dieser Bauanleitung verschiedene Aminosäuren in einer ganz bestimmten Reihenfolge zu einer Kette verknüpfen und damit das Protein herstellen.
Ein normales Protein wird durch die Aneinanderreihung von etwa 100 – 300 Aminosäuren gebildet. Dafür stehen zwanzig verschiedene Aminosäuren zur Verfügung, die jeweils anders aufgebaut sind und unterschiedliche spezifische Funktionen für das Protein erfüllen können. Diese Funktionen können sie aber erst ausüben, nachdem sie die korrekte räumliche Anordnung eingenommen haben. Der dafür notwendige Faltungsprozess findet ebenfalls im Zellplasma statt, noch während die Aminosäurekette noch am Ribosom synthetisiert wird.
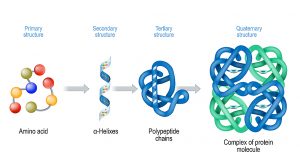
Zuerst interagieren die Moleküle im Proteinrückgrat
Die 3D-Struktur von Proteinen setzt sich aus mehreren Strukturebenen zusammen, die Schicht für Schicht gebildet werden. Am Anfang steht dabei die Aminosäurekette, welche die Primärstruktur bildet. Die Aminosäuren sind miteinander über spezielle Bindungen verknüpft, die im fertigen Protein das sogenannte „Rückgrat“ bilden.
Während die Aminosäurekette am Ribosom noch synthetisiert wird, falten sich an ihrem Anfang – also an den ersten zusammengeknüpften Aminosäuren – schon die Strukturen der zweiten Schicht, der Sekundärstruktur. Dazu gehören erste Interaktionen in Form von Wasserstoffbrückenbindungen zwischen den Molekülen der Aminosäuren, die das Rückgrat bilden. Je nach Position und Anordnungen dieser Bindungen formen sich die Aminosäureketten zu Spiralen, auch genannt Alpha-Helix, oder in flache, ziehharmonikaartig gefaltete Scheiben, den Beta-Faltblättern. Die Anordnung und Zusammensetzung dieser Sekundärstrukturen ist spezifisch für jedes Protein.
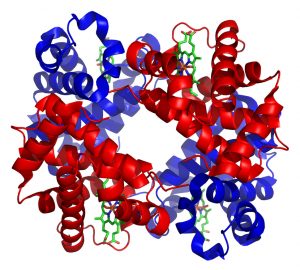
Jede Aminosäure hat ihren Platz
Die Tertiärstruktur wird durch weitere Gruppen von molekularen Bindungen zwischen den sekundären Strukturen der Aminosäurekette gebildet. Diese Bindungen sind zum Teil stärker als die Wasserstoffbrücken der Sekundärstruktur und werden von Atomen wie Stickstoff oder Schwefel geformt.
Vor allem wichtig für die tertiäre Struktur eines Proteins sind hydrophobe – also wasserabstoßende –Wechselwirkungen. Dabei interagieren Teile der Aminosäurekette, die eine ähnliche chemische Umgebung bevorzugen – in diesem Fall eine ohne Wasser – stärker miteinander, als mit anderen Teilen. Dies führt dazu, dass sich die hydrophoben Seitenketten der Aminosäuren im Inneren des Proteins zusammendrängen, während die hydrophilen – also wasserliebenden – Ketten auf der Oberfläche des Proteins exponiert sind und mit Wassermolekülen interagieren können.
Diese ersten drei Strukturschichten sind das Grundgerüst der Proteinfaltung. Manche Proteine bilden zusätzlich noch eine Quartärstruktur, indem sie mit anderen gefalteten Aminosäureketten zu einem Komplex fusionieren. Hämoglobin etwa, welches für den Sauerstofftransport in unserem Blut verantwortlich ist, besteht aus vier Untereinheiten.