{1r}
Anfang Juli 1913 – und damit vor fast genau hundert Jahren – veröffentlicht Bohr seine neuen Erkenntnisse unter dem Titel „On the Constitution of Atoms and Molecules“ im Philosophical Magazine, noch im gleichen Jahr folgen zwei weitere Veröffentlichungen. „Diese auch als Trilogie bekannten Artikel waren bahnbrechend, denn zum ersten Mal beschrieben sie, wie Atome funktionieren“, erklärt Troels Petersen, Physiker am dänischen Niels Bohr Institut in Kopenhagen.
Meilenstein mit kleinen Fehlern
Bohrs Kollegen und Zeitgenossen sind allerdings zunächst nur mäßig begeistert. Denn seine Theorie ist nur eine von vielen, die in dieser Zeit die Physikjournale füllen. Zudem passen Bohrs Berechnungen und Annahmen zwar für den Wasserstoff, bei Elementen mit mehr als einem Elektron weichen Beobachtungen und Theorie aber deutlich voneinander ab. Doch Bohr lässt sich nicht entmutigen. In den folgenden Jahren modifiziert und erweitert er sein Atommodell weiter. Er geht beispielsweise später nicht mehr von Kreisbahnen der Elektronen aus, sondern von elliptischen Orbits.
In der Folgezeit beschäftigt sich Bohr vor allem weiter mit den Konsequenzen der Planckschen Quanten für die atomare Welt und trägt so ironischerweise selbst tatkräftig dazu bei, die Quantenmechanik zu etablieren und sein Modell in vielen Punkten zu widerlegen.
Heute wissen wir, dass die Elektronen nicht in festen, flachen Bahnen kreisen, sondern in bestimmten Orbitalen zu finden sind – Zonen der höchsten Aufenthaltswahrscheinlichkeit. Denn spätestens seit Werner Heisenbergs Unschärferelation ist klar, dass sich die genaue Position und Geschwindigkeit eines Elementarteilchens nicht genau bestimmen lässt, ohne dessen Zustand zu beeinflussen. Zudem besitzen Elektronen – ähnlich wie Licht – auch Eigenschaften von Wellen.
Prägend bis heute
Doch trotz alledem: Das Bohrsche Atommodell – so vorläufig es auch war – ist auch heute noch immer das prägendste Modell. Es wird in den Schulen als erstes gelehrt, es findet sich in unzähligen Symbolen für Atome wieder und dient noch immer als Erklärungsmodell für zahlreiche Phänomene in Chemie und Physik. Mit seiner Hilfe wird beispielsweise bis heute die Bindung chemischer Elemente und letztlich auch das gesamte Periodensystem der Elemente erklärt.
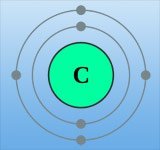
Denn nach diesem Modell ist eine chemische Bindung nichts anderes als ein Austausch der jeweils äußeren Elektronen zwischen Atomen. Beim Kochsalz beispielsweise gibt das Natrium sein einziges auf der äußeren Schale kreisendes Elektron ab, das Chlor nimmt dieses auf. Dadurch bekommen beide Atome eine nun volle Außenschale – und damit einen stabilen Zustand. Die Anzahl der Außenelektronen bestimmt damit letztlich, mit wem ein Element bevorzugt reagiert – und damit eine der Eigenschaften, die die Gruppenzuordnung im Periodensystem bestimmt.
Niels Bohr hat sich mit seinem „Planetenmodell“ der Elektronen tatsächlich unsterblich gemacht. Die bestrickende Einfachheit und Eingängigkeit seines Modells macht es bis heute relevant – wenn auch nicht in allen Aspekten. In dieser Hinsicht hat Bohrs Atommodell eine weitere Parallele zu einem Planetensystem, genauer gesagt dem des Astronomen Kopernikus: Beide Modelle änderten die Sicht auf ihre damalige Welt fundamental und öffneten die Tür zu weiteren Erkenntnissen – Erkenntnissen, die unser Weltbild bis heute prägen.
Nadja Podbregar
Stand: 21.06.2013