Echte Bindung oder nicht? Chemiker haben einen neuen Bindungstyp entdeckt – einen Zwitter zwischen zwei schon lange bekannten Formen der atomaren Kopplung. Diese kurze starke Wasserstoffbindung ist keine lose Wasserstoffbrückenbindung mehr, aber auch noch keine kovalente Molekülbindung. Dies wirft die Frage auf, ob die gängigen Definitionen der chemischen Bindung überarbeitet werden müssen, so die Forscher im Fachmagazin „Science“.
Der klassischen Definition nach sind die Unterschiede klar: Bei einer kovalenten Bindung teilen sich zwei Atome eines oder mehrere ihrer Außenelektronen, dadurch verschmelzen die Orbitale dieser Valenzelektronen zu einem Molekülorbital. Dieser Bindungstyp ist die Grundlage für alle organischen Moleküle, aber auch für das Wassermolekül oder den molekularen Sauerstoff (O2).
Anders bei der Wasserstoffbrückenbindung: Sie entsteht, wenn ein Wasserstoffatom in einem Molekül kovalent an einen stark elektronegativen Partner gebunden ist, beispielsweise an den Sauerstoff im H2O. Weil dieser die Bindungselektronen stärker zu sich zieht, entsteht ein leicht positive Teilladung am Wasserstoff. Zwischen diesem Donor-Atom und einem weiteren Partner mit negativer Teilladung kann sich dann eine größtenteils auf elektrostatischer Anziehung beruhende Kopplung aufbauen.
Solche Wasserstoffbrücken verleihen beispielsweise dem Wasser seine besondere Eigenschaften oder stabilisieren die 3D-Struktur von Proteinen, der DNA und anderen Biomolekülen.
Kurze starke H-Bindung passt nicht ins Bild
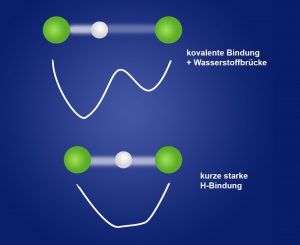
Doch es gibt Formen der Wasserstoffbrückenbindung, die Chemiker schon länger ins Grübeln bringen. Bei diesen kurzen starken Wasserstoffbindungen (short strong H-Bonds, SHB) wird das Wasserstoffatom von beiden Seiten nahezu gleich stark angezogen und die Brücke zum normalerweise losen Akzeptor ist fast genauso kurz wie die kovalente Bindung des Wasserstoffs zum Donor.
„Diese Bindungen stellen die klassischen Bindungskonzepte in Frage“, erklären Bogdan Dereka von der University of Chicago und seine Kollegen. Denn die Bindungsstärke dieser starken H-Brücken kommt der einer kovalenten Bindung sehr nahe und auch die Elektronenorbitale der verkoppelten Atome verändern sich. Wie genau die Energie dieser ungewöhnlichen Wasserstoffbrücken verteilt ist und wie stabil sie sind, haben Dereka und sein Team nun am Bifluorid-Anion (HF2–) untersucht.
In diesem Ion liegt das Wasserstoffatom genau zwischen den beiden Fluoratomen, obwohl gängiger Definition nach eine seiner Bindungen kovalent ist und die andere „nur“ eine Wasserstoffbrücke. Für ihre Studie analysierten die Forscher mithilfe der Infrarot-Spektroskopie die energieabhängigen Vibrationen des in Wasser gelösten Bifluorid-Ions.
Symmetrische Potenzialsenke und sich angleichende Merkmale
Die Analysen enthüllten: Die Bindungen im Bifluorid-Ion gleichen sich in ihrer Länge und ihrem Energiepotential stark an. Das Wasserstoffatom wird von beiden Fluoratomen geteilt und beide Bindungen bilden eine gemeinsame, symmetrische Potentialsenke, wie die Chemiker berichten. Dieses Gebilde bleibt auch dann stabil, wenn es in der wässrigen Lösung immer wieder mit Wassermolekülen und deren Wasserstoffbrücken in Kontakt kommt.
Das Entscheidende jedoch: Aus ihren Daten und ergänzenden Modellen ermittelten die Forscher, dass die starke H-Bindung im Bifluorid-Ion sich auch von seiner Natur her einer kovalenten Bindung angleicht. „Elektrostatische Anziehung macht nur noch 52 bis 62 Prozent der Bindungsenergie aus und der kovalente Ladungstransfer (…) spielt eine zunehmende Rolle“, erklären sie. Wie bei der kovalenten Bindung kommt es zur Überlappung und Verformung der Elektronenorbitale.
Hybride Bindungsform
Nach Ansicht von Dereka und seinen Kollegen spricht all dies dafür, dass es sich bei dieser kurzen starken H-Bindung um eine echte Zwischenstufe zwischen Wasserstoffbrücke und kovalenter Bindung handelt. „Unsere Ergebnisse deuten darauf hin, dass die SHB am Kipppunkt liegt – dort, wo die Wasserstoffbrücke endet und die echte chemische Bindung beginnt“, schreiben sie.
Damit handelt es sich bei diesem „Zwitter“ um eine neue Bindungsform, die „zwischen den Stühlen“ der klassischen Definitionen liegt. Dies wirft die Frage auf, wie eine chemische Bindung genau definiert wird und wie passend die gängigen Vorstellungen noch sind, konstatieren Mischa Bonn und Johannes Hunger vom Max-Planck-Institut für Polymerforschung in einem begleitenden Kommentar.
„Gleichzeitig eröffnet die Existenz dieser Hybrid-Bindung die Chance, chemische Reaktionen besser zu verstehen“, erklären sie. Denn bei diesen Umlagerungen, Auftrennungen oder Anbahnungen von Bindungen treten oft intermediäre Zustände auf, bei denen Wasserstoffbrücken und auch starke H-Bindungen eine Rolle spielen. (Science, 2021, doi: 10.1126/science.abe1951)
Quelle: Science