Überraschend simpel: Der Schritt von Fledermaus-Coronaviren zu humanpathogenen Formen wie SARS-CoV-2 ist möglicherweise kleiner als gedacht. Denn der Austausch einer entscheidenden Aminosäure am viralen Spike-Protein reicht, um dem Fledermausvirus RaTG13 das Befallen menschlicher Zellen zu ermöglichen, wie nun Laborversuche belegen. Beruhigend immerhin: Unsere mRNA-Impfstoffe würden selbst gegen dieses mutierte Fledermausvirus wirken, wie die Forscher ermittelten.
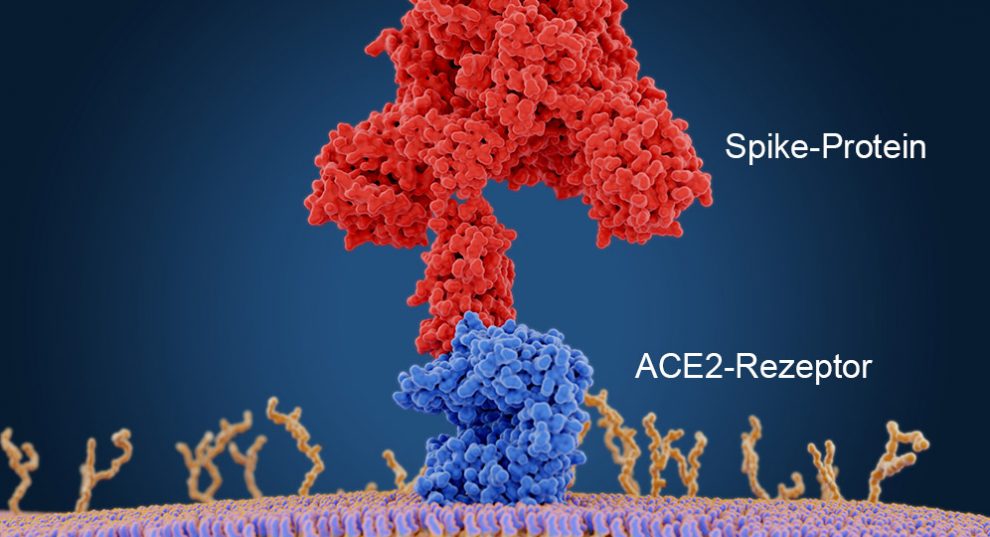
Aus welchem Tier-Coronavirus hat sich der Pandemie-Erreger SARS-CoV-2 entwickelt? Bisher gibt es darauf keine eindeutige Antwort. Der aus Hufeisennasen im chinesischen Yunnan isolierte und im Virenlabor von Wuhan kultivierte Stamm RaTG13 stimmt genetisch zu 96 Prozent mit SARS-CoV-2 überein. Er kann aber nicht an den ACE2-Rezeptor auf den menschlichen Zellen andocken.
Anders ist dies bei zwei aus Schuppentieren isolierten Coronaviren und bei drei aus Fledermäusen in Laos stammenden Virenstämmen. Letztere binden nicht nur an menschliche Zellen, sie sind SARS-CoV-2 auch ähnlicher als RaTG13 – insbesondere an der Rezeptorbindungsdomäne des viralen Spike-Proteins. Die drei BANAL getauften Coronaviren aus Laos gelten daher momentan als die nächsten Verwandten des Pandemie-Erregers.
Position 403 im Visier
Doch wo liegen die entscheidenden Unterschiede zwischen RaTG13, den drei Laos-Viren und SARS-CoV-2? Um mehr darüber herauszufinden, haben sich Fabian Zech von der Universität Ulm und seine Kollegen die Aminosäure an Position 403 des viralen Spike-Proteins näher angeschaut. „Frühere Simulationen legten nahe, dass R403 signifikant zur Interaktion der Bindungsdomäne von SARS-CoV-2 mit dem ACE2-Rezeptor beiträgt“, erklären die Forscher.
Sowohl der Pandemie-Erreger SARS-CoV-2 als auch sein Vorgänger SARS-CoV tragen an Position 403 eine positiv geladene Aminosäure – Arginin (R) beziehungsweise Lysin (K). Die Form dieses Proteinbausteins und seine positive Teilladung ermöglichen es ihm, eng mit einem Glutaminsäure-Baustein des menschlichen ACE2-Rezeptors zu wechselwirken – dessen negative Teilladung erleichtert die Bindung. Anders dagegen RaTG13: Bei ihm sitzt an Position 403 die Aminosäure Threonin (T), die eine neutrale Seitenkette aufweist.
Vertauschte Aminosäuren
Was aber würde passieren, wenn man beim Fledermausvirus RaTG13 die Aminosäure Threonin gegen Arginin austauscht? Um das zu testen, erzeugte das Team Pseudoviren mit dem Spike-Protein von RaTG13 und einer solchen T403R-Mutation. Zum Vergleich produzierten sie SARS-CoV-2-Pseudoviren mit der umgekehrten Mutation. Beide Virentypen gaben sie anschließend zu menschlichen Zellkulturen.
Das überraschende Ergebnis: Während RaTG13 normalerweise nicht an menschliche Zellen binden kann, war dies bei den Fledermaus-Pseudoviren mit der T403R-Mutation der Fall. „Die gezielte Mutation einer Aminosäure im Spike-Protein des RaTG13, genauer gesagt an Position 403, erlaubt es diesem Fledermaus-Coronavirus, am selben Rezeptor anzudocken wie SARS-CoV-2: dem humanen ACE2-Rezeptor“, sagt Seniorautor Frank Kirchhoff vom Universitätsklinikum Ulm.
Entscheidender Baustein für die Infektiosität
Anders als bisher gedacht reicht demnach schon diese eine Mutation aus, um RaTG13 auch für humane Zellen infektiös zu machen. Ähnlich wie SARS-CoV-2 löste das mutierte Fledermausvirus zudem die Fusion von befallenen Zellen aus. „Der starke Effekt des T403R-Austauschs bei RaTG13 war eine Überraschung, denn fünf der sechs Protein-Bausteine, die als entscheidend für die ACE2-Rezeptorbindung von SARS-CoV-2 galten, sind bei RaTG13 nicht vorhanden“, schreibt das Team.
Das legt nahe, dass der positiv geladenen Aminosäure an Position 403 eine überdurchschnittlich große Bedeutung zukommt. Bestätigt wurde dies durch den umgekehrten Tausch: Das SARS-CoV-2-Pseudovirus mit Threonin statt des Arginins zeigte eine verringerte Infektiosität, wie Zech und seine Kollegen feststellten. Obwohl der Pandemie-Erreger ansonsten bestens an unsere Zellen angepasst ist, reichte diese eine Mutation aus, um seine Bindungsfähigkeit zu mindern.
Voraussetzung für weitere Artsprünge?
Damit könnte das Forschungsteam einen entscheidenden Schritt für den Artsprung des Coronavirus gefunden haben. „Zusammengenommen deuten unsere Ergebnisse darauf hin, dass eine positive Aminosäure-Einheit an Position 403 des Spike-Proteins eine Voraussetzung für die effiziente zoonotische Übertragung und die pandemische Ausbreitung von SARS-CoV-2 war“, schreiben Zech und seine Kollegen.
Gleichzeitig legen die Resultate aber auch nahe, dass es im Tierreich und im Speziellen bei Fledermäusen viele Coronaviren geben könnte, die dieses entscheidende Merkmal bereits besitzen. Auch die Laos-Fledermausviren und die Pangolinviren tragen von Natur aus an Position 403 schon eine positiv geladene Aminosäure.
Tröstlich immerhin: In ergänzenden Tests wirkten Antikörper aus menschliche Blutseren von Geimpften und Genesenen auch gegen den künstlich mutierten Stamm von RaTG13. Trotz der vielen genetischen Unterschiede könnten die aktuellen Corona-Impfungen demnach auch gegen nahe verwandte Coronaviren und zukünftige Zoonosen schützen. „Die Covid-19-Impfung könnte also helfen, ein zukünftiges Überspringen solcher viralen Erreger auf den Menschen zu verhindern“, erklären Zech und seine Kollegen. (Nature Communications, 2021; doi: 10.1038/s41467-021-27180-0)
Quelle: Universität Ulm