Er ist das große Damoklesschwert, eine gefürchtete Plage unserer Zeit: Krebs. Millionen von Menschen weltweit leiden an der Krankheit mit den vielen Gesichtern, täglich müssen sich Tausende neu mit der Diagnose auseinandersetzen. Denn trotz modernster Technologien und Behandlungsstrategien bedeutet sie in vielen Fällen noch immer ein Todesurteil. Entsprechend fieberhaft suchen Mediziner nach den Ursachen für den bösartigen Amoklauf der Zellen.
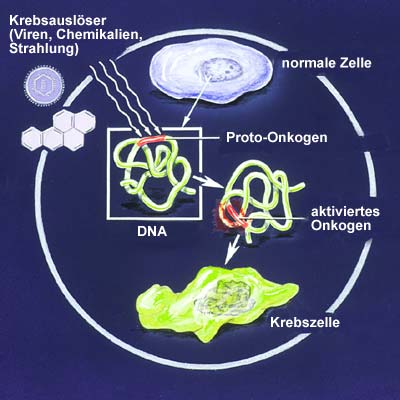
Was löst dieses unkontrollierte Zellwachstum, die bösartige Wucherung aus? Gift, Strahlung, Erbanlagen – in einigen Fällen sind die Auslöser zumindest eingekreist, doch im Gegensatz zu vielen Infektionskrankheiten ist es bei Krebs mit einem einfachen Ursache-Wirkungs-Prinzip nur selten getan. Oft löst erst das Zusammenwirken mehrerer Faktoren die fatale Transformation von der normalen Körperzelle zur entarteten Krebszelle aus. Das komplexe Gefüge dieser Interaktionen haben die Wissenschaftler jedoch heute erst in Ansätzen durchschaut.
Unter den vielen Faktoren ist einer erst in den letzten Jahren in den Blickpunkt des Forscherinteresses gelangt: Tumorviren. Obwohl Wissenschaftler schon Anfang des letzten Jahrhunderts erste Hinweise auf eine Krebs auslösende Wirkung von Viren entdeckten, wurden ihre Ergebnisse zunächst Jahrzehnte lang schlicht ignoriert. Die herrschende Lehrmeinung verbot sich jeden Zusammenhang zwischen übertragbaren Krankheitserregern und den – nicht übertragbaren – Tumorerkrankungen.
Auch wenn sich letztendlich die Erkenntnis durchsetzte, dass Krebs und Viren sehr wohl etwas miteinander zu tun haben, mussten die Forscher auf diesem Gebiet wie auf kaum einem anderen gegen ein wahres Bollwerk aus Widerständen anrennen. Bis in die jüngste Zeit reicht diese Geschichte der Ignoranz, aber auch der Beharrlichkeit. Sie ist damit geradezu ein Paradebeispiel für den vom österreichischen Ingenieur und Schriftsteller Robert Musil beschriebenen typischen Ablauf des wissenschaftlichen Fortschritts: „Alle paar Jahre…revolutioniert etwas, das bis dahin als Irrtum galt alle bisherigen Sichtweisen,… eine verachtete Idee wird plötzlich zum Herrscher über ein neues Reich.“
Und das „neue Reich“ gewinnt zusehends an Größe: Immer mehr Viren werden von Krebsforschern auf die Liste der „Verdächtigen“ gesetzt, rund ein Dutzend sind bereits zweifelsfrei identifiziert. Darunter auch so verbreitete und vermeintlich harmlose Erreger wie das Papillomavirus oder andere Herpesarten. Noch sind zwar die Mechanismen der Krebsentstehung durch Viren nur im Groben bekannt, doch die Forschung arbeitet auf Hochtouren. Denn ist dieser Prozess verstanden, eröffnen sich auch neue, Hoffnung bringende Wege für Vorbeugung und Therapie…
Nadja Podbregar
Stand: 15.10.2004