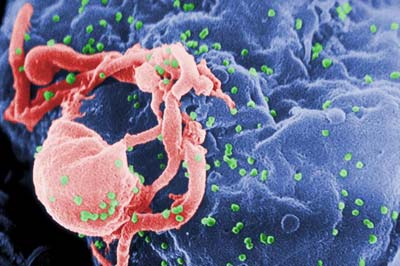
Auch Braunbärmännchen töten fremde Jungtiere - hier eine Mutter mit ihren drei Jungen. © Arend / CC-BY-SA 2.0
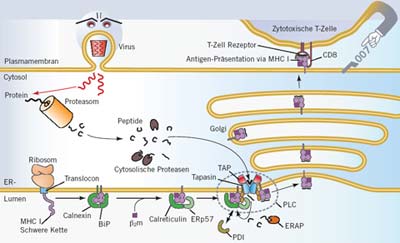
Der Prozess der Präsentation des körpereigenen Proteoms in Form von Abbaubruchstücken besteht dabei aus vielen Teilschritten, die streng reguliert und geordnet ablaufen. Im Cytosol und im Kern jeder Zelle wird der Proteinabbau in einem komplexen Vorgang über den so genannten Proteasom-Komplex, einen makromolekularen Schredder, vermittelt. Dabei wird eine Vielfalt von Proteinbruchstücken erzeugt, die über eine Membran in das Endoplasmatische Retikulum (ER) gebracht werden müssen, damit sie an der Zelloberfläche präsentiert werden können. Diesen wichtigen Transport und die folgende Beladung auf das bereits erwähnte MHC-I-Molekül führt eine membrangebundene, makromolekulare Maschine aus: der Peptid-Beladungs-Komplex – PLC, peptide loading complex).
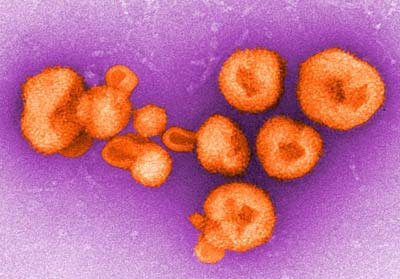
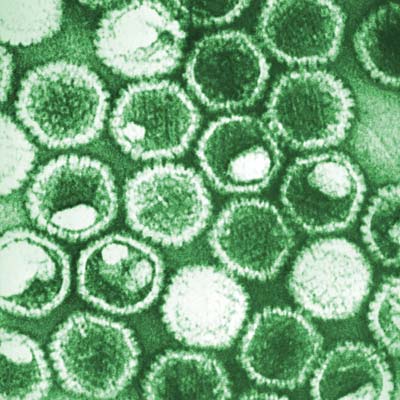
Arenavirus löst hämorrhagisches Fieber aus © Charles Humphrey / CDC
Qualitätskontrolle beim Ladevorgang
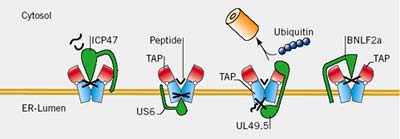
Der Peptid-Beladungs-Komplex besteht aus einer Reihe zellulärer Komponenten – Transporter assoziiert mit Antigenprozessierung TAP, Tapasin, β2-Mikroglobulin β2m, MHC I, ERp57, Calreticulin -, wobei der Transporter TAP im Zentrum steht. Er besteht aus zwei Membranproteinen, TAP1 und TAP2, die die essenzielle Aufgabe übernehmen, Peptide ins Innere des Endoplasmatischen Retikulums zu befördern, wo sie auf MHC-I-Moleküle geladen werden.
Nach einer Qualitätskontrolle, die eine optimale Peptid-Beladung gewährleistet, nimmt die Fracht ihren Weg über weitere Kompartimente der Zelle und gelangt schließlich zur Zelloberfläche. Bestandteile eines Virus, der eine Körperzelle befällt, oder Tumor-assoziierte Antigene werden ebenso präsentiert wie alle körpereigenen Fragmente. Folglich ist der Prozess der Präsentation über das MHC-I-Molekül die Grundlage zur Unterscheidung der körpereigenen Fragmente von Fremdkörpern, Erregern und entarteten Zellen.
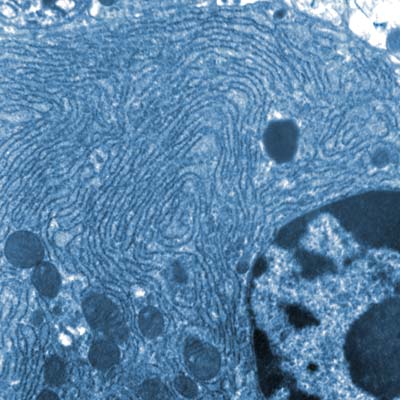
Zelle mit Kern, Mitochondrien und Endoplasmatischem Reticulum © Louisa Howard / Dartmouth College / gemeinfrei
Hilfe für Bond
Der Peptidbeladungskomplex ist aufgrund seiner medizinischen Relevanz – hier also seiner Nähe zu Bond und seinen Verbündeten – eine intensiv untersuchte „Molekulare Maschine“ unserer Zellen. Trotz einer klaren Trennung der Aufgaben in der Zelle existiert bei der Peptid-Beladung und Präsentation eine Kommunikation vom Zytosol ins ER über den so genannten sekretorischen Weg bis hin zur Oberfläche der Zelle. Dabei gilt es nicht nur, die „Trennung“ der Kompartimente durch die biologische Membran zu überwinden, sondern auch die grundverschiedenen biochemischen Eigenschaften der molekularen Umgebung für den Transport der Peptide an die Oberfläche der Zelle zu nutzen.
Das genaue Verständnis aller Teilschritte der Antigenpräsentation – Abbau durch das Proteasom, Erkennung und Transport der Bruchstücke ins ER, Beladung von MHC I und intrazellulärer Transport an die Zelloberfläche – ist für die Unterstützung von Bond und Verbündeten durch die moderne Medizin unerlässlich.
Daphne Nikles und Robert Tampé / Forschung Frankfurt
Stand: 23.10.2009