Die Arbeitsgruppe von Thomas Grunwald konzentriert sich inzwischen auf die Suche nach weiteren Möglichkeiten der Nukleinsäure-basierten Impfung, denn die Probleme bei der Anwendung von adenoviralen Vektoren beim Menschen sind vielfältig. Zum einen ist die Herstellung kompliziert, zum anderen kann die Immunreaktion bei Menschen den Impferfolg schmälern.
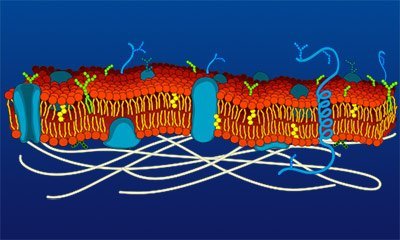
Membran einer Körperzelle. Bei der Elektroporation wird sie kurzzeitig für größere Moleküle durchlässig. © gemeinfrei
Elektrischer Impuls als Passage-Helfer
Neue Techniken der DNA-Übertragung in vivo sind derzeit in der Entwicklung. Eine, die seit kurzem Anwendung in klinischen Studien bei Menschen findet, ist die sogenannte in vivo Elektroporation. Dabei sorgen kurze elektrische Impulse im Moment der Impfung dafür, dass Membranen der Körperzellen durchlässig werden und sie die fremde DNA daher sehr effizient aufnehmen. Dadurch wird die Bildung des in der DNA kodierten RSV-F-Proteins im Impfling verstärkt. Diese Methode wird zurzeit als DNA-basiertes Impfverfahren getestet, wobei es bei HIV-, Influenza-Virus- und Hepatitis-C-Virus-Impfstoffen bereits vielversprechende Ergebnisse zur deren Immunogenität geliefert hat. Eine 2011 veröffentlichte klinische Phase I-Studie, bei der ein HIV-DNA-Impfstoff mittels Elektroporation verabreicht wurde, zeigt, dass die Anwendung als sicher und für eine prophylaktische Impfung als akzeptabel eingestuft werden kann.
Diese Technik der in vivo Elektroporation haben die Forscher in Zusammenarbeit mit dem Virologen Matthias Tenbusch von der Ruhr-Universität seit einiger Zeit bereits für das Maus-Tiermodell etabliert. Auch nach Immunisierung mit der RSV-F-DNA bei Mäusen und bei Primaten zeigen diese eine hohe RSV-spezifische Immunantwort. Eine abschließende präklinische Wirksamkeitsstudie des RSV-F-DNA-Impfstoffs ist bereits in Planung. Ist sie erfolgreich, soll der RSV-F-DNA-Impfstoff am Menschen in einer klinischen Phase I-Studie getestet werden. Aufgrund Erfahrungen mit DNA-Impfstoffen beim Menschen und gut etablierten Produktionsbedingungen – diese DNA wird üblicherweise in Bakterien hergestellt – sollte nach Einschätzung der Forscher die Überführung in die klinische Prüfung rasch erfolgen können.

Krankenhaus: oft Ort unnötiger Scmerzen © gemeinfrei
Großer Schritt nach vorne
Ein wirksamer Impfstoff gegen RSV auf Basis von DNA wäre ein riesiger Schritt nach vorne. Bis dahin sind jedoch noch viele Schritte zu gehen und viele Prüfungen zu bestehen. Die Weltgesundheitsorganisation (WHO) klassifiziert Impfstoffe zu den effektivsten und kostengünstigsten Strategien zur Bekämpfung und Kontrolle von Infektionskrankheiten. Hinsichtlich des Einflusses auf die Gesundheit der Menschen weltweit stehen Impfstoffe an zweiter Stelle nach der Versorgung mit sauberem Trinkwasser.
Erweist sich der in Entwicklung befindliche Impfstoff als wirksam gegen die RSV-Infektion und/oder die durch sie verursachte Symptomatik, könnten vor allem Kinder und alte Menschen künftig davor geschützt werden. Darüber hinaus ist eine mögliche Kombination mit anderen DNA-basierten Impfstoffen attraktiv, die dann zum Beispiel vor anderen wichtigen Atemwegsviren schützen kann.
Grundsätzlich hat ein DNA-Impfstoff mehrere Vorteile: Er ist sehr sicher. DNA ist nicht infektiös und kann sich nicht von Zelle zu Zelle ausbreiten. Seine Lagerung ist einfach, da die verwendete DNA relativ Temperatur-unempfindlich ist. DNA-Impfstoffe sind schnell und relativ kostengünstig herstellbar. Darüber hinaus kann die Produktion eines DNA-Impfstoffes relativ problemlos ausgeweitet werden, so dass auch weltweite Impfprogramme durchführbar wären. Noch ist allerdings unklar, wie häufig die Impfung wiederholt werden muss und ob der Impfstoff wie die Grippeimpfung jedes Jahr gegeben werden muss.
RUBIN Sonderheft Transfer, Dr. Thomas Grunwald, Ruhr-Universität Bochum
Stand: 05.10.2012