Umstrittenes Schwergewicht: Das Element Lawrencium steht möglicherweise an der falschen Stelle des Periodensystems. Denn wie ein Experiment nun erstmals zeigt, ist seine Ionisierungs-Energie verblüffend niedrig – niedriger als die aller anderen Actinoide und Lanthanoide. Dies heizt die Diskussion über die Position dieses kurzlebigen Elements wieder an – und über die Ordnung des Periodensystems insgesamt.
Die Position im Periodensystem spiegelt die Grundeigenschaften eines Elements wider: In welcher Gruppe sie stehen, verrät beispielsweise, wie viele Elektronen ihrer äußeren Hülle sie in einer chemischen Reaktion abgeben oder wie viele Elektronen sie vom Reaktionspartner aufnehmen. Auch die Leichtigkeit, mit der dies geschieht, lässt sich an der Position ablesen. Die großen Blöcke des Periodensystems zeigen, welches Elektronenorbital dabei die entscheidende Rolle spielt.
Eine Frage der Elektronen
Um herauszufinden, wohin ein Element im Periodensystem gehört, muss man daher die Anordnung seiner Elektronen kennen, aber auch seine Ionisierungs-Energie – die Energie, die benötigt wird, um ihm eines seiner Außenelektronen wegzunehmen. Bei alltäglichen, stabilen Elementen wie Sauerstoff oder Eisen ist das nicht weiter schwer, bei den superschweren, teilweise extrem kurzlebigen Elementen, die sich am unteren Rand des Systems tummeln, aber schon.
Einer dieser Wackelkandidaten ist Lawrencium (Lr), denn seine Ionisierungs-Energie war bisher nicht bekannt. Das Element mit der Ordnungszahl 103 steht vorläufig ganz am Ende der Actinoide, einer Gruppe, die zusammen mit den Lanthanoiden einen eigenen Block im Periodensystem bildet. In diesem f-Block bleibt die äußere Schale unverändert, die Atome erhalten aber von Element zu Element jeweils ein Elektron im drittäußersten f-Orbital hinzu.
Nur 27 Sekunden Zeit
Doch neue Daten könnten nun diese Position von Lawrencium in Frage stellen. Tetsuya Sato von der Japanischen Atomenergiebehörde JAEA und seinen Kollegen ist es erstmals gelungen, Lawrencium zu ionisieren und die dafür benötigte Energie zu messen – und ihre Ergebnisse wiedersprechen nach Ansicht einiger Chemiker der derzeitigen Einordnung.
Für ihr Experiment erzeugten Sato und seine Kollegen zunächst Lawrencium-Atome, indem sie Boratome auf ein Ziel aus Californium schossen – einem Actinoid mit der Ordnungszahl 98. Dabei entsteht alle paar Sekunden ein Lawrencium-Isotop mit einer Halbwertzeit von 27 Sekunden. Das gab den Forschern gerade genug Zeit, um diese Atome in einer Wolke aus Kadmiumiodid einzufangen und auf eine rund 2.500 Grad heiße Metallplatte zu leiten. Diese Hitze katapultierte bei einigen der Atome ein Elektron aus den Orbitalen – es wurde ionisiert.
Elektronklau ging überraschend leicht
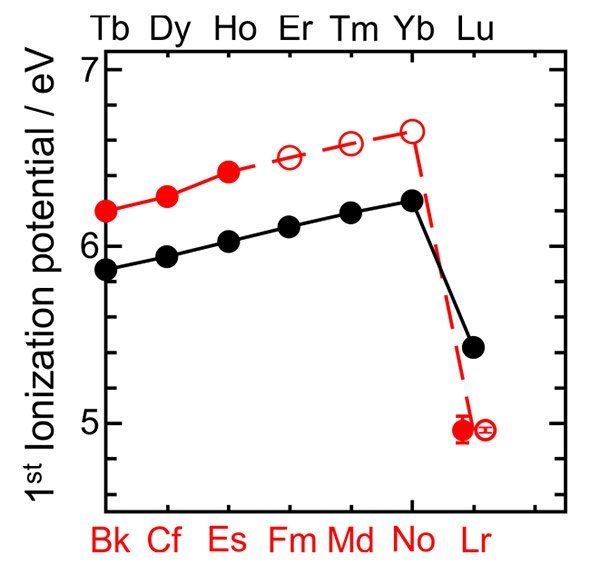
Als die Forscher aber die Ionisierungsenergie berechneten, erlebten sie eine Überraschung: Sie lag nur bei 4,96 Elektronenvolt. „Das ist ungewöhnlich niedrig“, sagte Sato gegenüber dem Fachmagazin „Nature“. Denn Lawrencium lässt sich damit nicht nur leichter ein Elektron klauen als alle anderen Lanthanoide und Actinoide, es hat auch die fünftniedrigste Ionisierungsenergie des gesamten Periodensystems.
Was aber bedeutet dies für die Elektronenkonfiguration des Lawrenciums – und für seine Position im Periodensystem? Darüber herrscht bislang keine Einigkeit. Einige Autoren des „Nature“-Papers halten das Element weiterhin im f-Block für am besten aufgehoben. So konstatiert Christoph Düllmann von der Universität Mainz: „Wir zeigen, dass die Energie zum Ablösen des äußersten Elektrons bei Lawrencium wie erwartet am geringsten von allen Actinoiden ist.“ Dies bestätige die Position von Lawrencium als letztes Mitglied in der Reihe der Actinoiden und untermauere die Architektur des Periodensystems der Elemente.
…oder doch falsch positioniert?
Es gibt aber auch Chemiker, die dies ganz anders sehen, unter ihnen William Jensen von der University of Cincinnati. Er argumentiert, dass Lawrencium nicht zu den anderen Actinoiden passt – ähnlich wie auch Lutetium, das letzte Lanthanoid nicht zu seiner Gruppe. Denn bei beiden fällt die Ionisierungsenergie im Vergleich zu ihren Nachbarn steil ab. Zudem haben alle anderen Actinoide eine höhere Ionisierungsenergie als die über ihnen stehenden Lanthanoide, nur bei Lawrencium und Lutatium sei es umgekehrt. Seiner Ansicht nach müsste Lawrencium stattdessen direkt unter Scandium und Yttrium stehen – und damit im d-Block des Periodensystems.
Die International Union of Pure and Applied Chemistry (IUPAC), das weltweit entscheidende Gremium in allen offiziellen Fragen der Chemie, nimmt bisher weder die eine noch die andere Position ein, wie Jan Reedijk, Präsident der Anorganik-Sektion der IUPAC gegenüber „Nature“ erklärte. Das Gremium werde dieses Thema aber im Sommer auf einer Sitzung erörtern. (Nature, 2015; doi: 10.1038/nature14342)
(Nature News / Nature/ Universität Mainz, 09.04.2015 – NPO)













