Künstlich hergestelltes Erythropoetin, kurz EPO, gilt als eines der wichtigsten Dopingmittel für Radrennfahrer. Es wird aber auch zur Behandlung der Blutarmut von Dialysepatienten und nach aggressiven Chemotherapien eingesetzt. Einem japanisch-britischen Team um Yasuhiro Kajihara ist es nun gelungen, Analoga dieses Faktors in einer halb biotechnologischen, halb chemischen Synthese herzustellen.
Wie die Forscher in der Zeitschrift „Angewandte Chemie“ berichten, könnte dieser Syntheseweg ein interessanter prinzipieller Ansatz zur Herstellung so genannter Glycoproteine sein – Eiweißen, die Seitenketten aus Zuckerbausteinen tragen.
Körpereigener Wachstumsfaktor
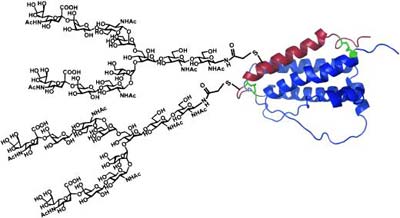
Der Name EPO leitet sich vom altgriechischen erythros „rot“ und poiein „machen“ ab, eine treffende Bezeichnung für diesen wichtigen körpereigenen Wachstumsfaktor, der für die Bildung roter Blutkörperchen verantwortlich ist. EPO ist ein gut untersuchtes Glycoprotein mit einer bekannten, klar umrissenen biologischen Funktion. Daher ist es als Modell-Glycoprotein beliebt. 166 Aminosäuren bilden seinen Eiweißteil, an den vier komplexe Zuckerketten (Oligosaccharide) wie mehrendige Antennen gebunden sind. Sie verlängern die Lebensdauer des Proteins im Blut.
Glycoproteine sind wichtige pharmakologische Wirkstoffe. Ihre Produktion ist jedoch schwierig. In Zellkultur entstehen keine einheitlichen Zuckerketten. Bakterien sind zudem nicht in der Lage, die komplexen Zuckerketten von Säugerproteinen nachzubauen. Von der Alternative, der chemischen Synthese, erhofft man sich maßgeschneiderte, einheitliche Glycoproteine, die als Wirkstoffe und zur Erforschung der Funktion von Glycoproteinen dienen können. Allerdings ist diese sehr aufwendig.
Künstliche Verankerungsstelle
Das Team wählte einen Mittelweg: Sie erzeugten nur einen Teil der EPO-Eiweißkette biotechnologisch in einer Bakterienkultur. Den zweiten, kürzeren Teil der Eiweißkette mit den Zuckerantennen synthetisierten sie. Dazu fügten sie eine künstliche Verankerungsstelle ein, an der Zucker chemisch angeknüpft werden können. Bei der verwendeten Zuckerkette handelte es sich um ein verzweigtes komplexes Sialyloligosaccharid aus Eigelb. Im letzten Schritt verknüpften die Forscher die beiden Eiweißketten mithilfe einer Methode, die sich native chemische Ligation nennt.
Faltungsexperimente belegten, dass das künstliche EPO-Analogon wie das natürliche EPO eine helikale Struktur einnimmt. Zellteilungstests mit Knochenmarkszellen ergaben eine gleich hohe biologische Aktivität wie beim Original. In vivo konnte das Analogon allerdings die Zahl der roten Blutkörperchen nicht in der Weise erhöhen wie das richtige EPO, so die Forscher. Sie hoffen nun, durch Verwendung anderer, stärker verzweigter Zuckerketten Analoga zu kreieren, die auch in vivo eine hohe Bioaktivität zeigen.
(Gesellschaft Deutscher Chemiker, 22.10.2009 – DLO)