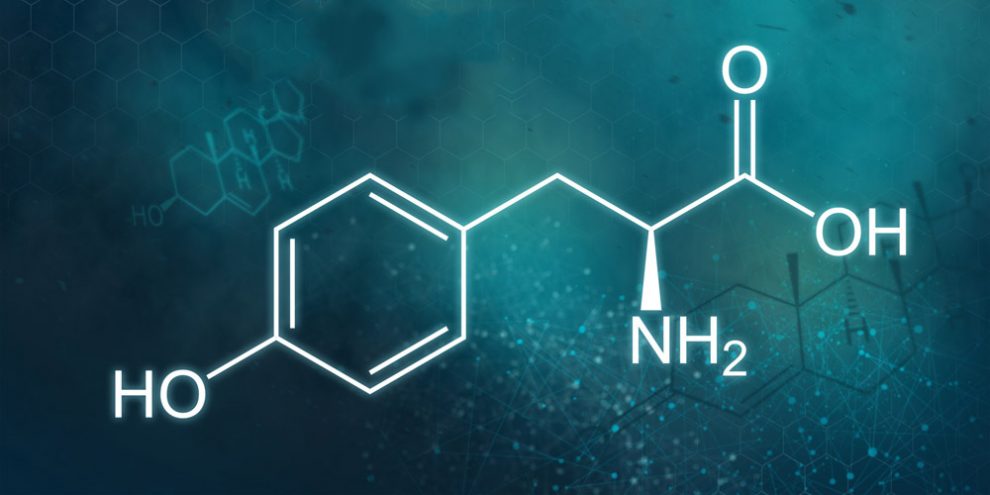
Wanderndes Atom: Chemiker haben bei der Aminosäure Tyrosin eine unerwartete Reaktion beobachtet – das Roaming. Unter dem Einfluss von Licht löst sich dabei ein Wasserstoffatom aus dem Molekül, wandert um dieses herum und lagert sich an anderer Stelle wieder an. Diese zuvor noch nie bei einem Biomolekül beobachtete Reaktion fördert den Zerfall des Moleküls und kann freie Radikale erzeugen. Die Forschenden vermuten, dass auch andere Peptide und Aminosäuren ein solches Roaming zeigen können.
Führt man Atomen und Molekülen Energie in Form von Strahlung zu, verändert dies ihren Zustand: Sie absorbieren einen Teil der Energie und ihre Elektronen wechseln auf ein höheres Energieniveau. Je nach Intensität dieser Anregung führt dies zur Ionisation und „sprengt“ ein Elektron vom Atom ab oder aber das Atom fällt unter Abgabe eines Photons wieder in den Grundzustand zurück. Diese Licht-Materie-Interaktionen hat schon Albert Einstein vorhergesagt.
Reaktion einer Aminosäure auf Licht untersucht
Doch bei einigen Molekülen gibt es offenbar noch eine andere Reaktion auf Licht, wie nun Julia Westermayr von der Universität Wien und ihre Kollegen entdeckt haben. Für ihre Studie hatten sie die Reaktion der Aminosäure Tyrosin auf Lichtanregung untersucht, einer von nur drei essenziellen Aminosäuren im menschlichen Körper, für die eine photochemische Reaktion bekannt ist. Die lichtinduzierte Anregung und Fragmentierung des Tyrosins steht im Verdacht, Prozesse wie die Hautalterung oder den Grauen Star zu fördern.
Allerdings sind die im Experiment beobachteten Reaktionen des Tyrosins nur schwer quantenchemisch zu interpretieren, weshalb Forschende die Vorgänge mithilfe von Simulationen zu rekonstruieren versuchen. Westermayr und ihr Team haben dafür mehrere Methoden miteinander kombiniert und eine künstliche Intelligenz eingesetzt, um aus der Vielzahl der möglichen Abläufe die tatsächlichen Vorgänge herauszulesen.
„Die über quantenchemische Rechnungen auf Supercomputern generierten, verschiedenen Trainingsdaten wurden von unserem neuronalen Netz zusammengesetzt und damit waren die Bewegungen von Tyrosin nach photochemischer Anregung in alle Richtungen nachvollziehbar“, erklärt Westermayr.
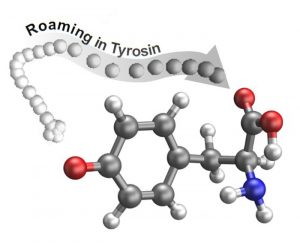
Vagabundierendes Wasserstoffatom
Dabei zeigte sich Überraschendes: „Nach dem Auftreffen von Licht löst sich unerwartet ein Atom von Tyrosin, fliegt los und umrundet den Rest des Tyrosin-Moleküls eine Zeit lang wie eine Fliege, die um ein Pferd umherschwirrt“, beschreibt Westermayrs Kollege Philipp Marquetand die Beobachtungen. Der Weg des umherfliegenden Fragments, einem Wasserstoff-Radikal, weiche vollkommen von bekannten Umlagerungspfaden ab und entspreche nicht dem, was man basierend auf chemischen Regeln erwarten würde.
Nach dem Ende dieses als „Roaming“ bezeichneten Umherfliegens lagerte sich das vagabundierende Wasserstoffatom an anderer Stelle der Aminosäure an und löste dadurch die Umlagerung eines weiteren Wasserstoffatoms im Molekül aus. Dieser Prozess kann einige hundert Femtosekunden bis zu einigen Nanosekunden lang dauern, wie das Team berichtet.
Roaming mit Folgen für das Biomolekül
Damit hat das Chemikerteam erstmals das erst 2004 entdeckte Phänomen des Roamings bei einem Biomolekül nachgewiesen. Zuvor war diese ungewöhnliche Form der Umlagerung in einem Molekül nur bei Formaldehyd beobachtet worden. Für die Aminosäure Tyrosin ist dieses Vagabundieren eines Atoms allerdings wenig vorteilhaft: Tritt Roaming auf, bleiben nur 36 Prozent der Moleküle stabil, 64 Prozent hingegen zerfallen ganz oder teilweise.
Nähere Analysen ergaben zudem, dass es sich bei dem vagabundierende Wasseratom nicht um ein bloßes Proton, sondern um ein Radikal handelt – ein chemisch sehr reaktives Atom mit einem einzelnen Elektron. Dadurch und durch die Dissoziation der Aminosäure könnte das Roaming eine wichtige Rolle für die Reaktion von Proteinen und anderen Biomolekülen auf Licht spielen, wie das Team erklärt. (Nature Chemistry, 2022; doi: 10.1038/s41557-022-00950-z)
Quelle: Universität Wien