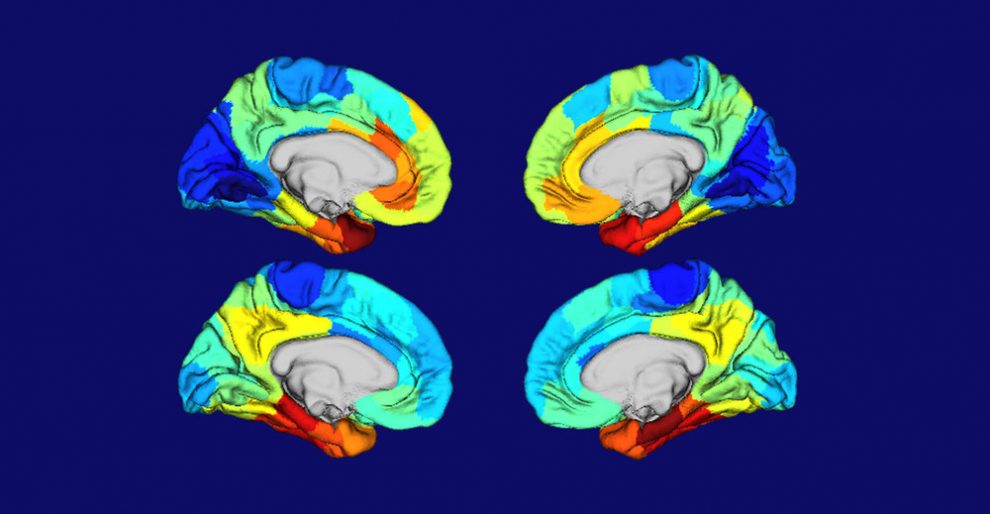
Wo im Gehirn Alzheimer zuerst Hirnzellen absterben lässt, ist nicht bei allen Betroffenen gleich. Bei vielen beginnt der Abbau im Gedächtniszentrum, bei anderen treten als erstes Seh- und Sprachstörungen auf. Warum, könnte jetzt ein Forschungsteam aufgeklärt haben. Demnach spielt die lokal unterschiedliche Aktivität von Risiko-Genvarianten wie APOE-4 im Gehirn eine entscheidende Rolle dafür, wo sich zuerst die schädlichen Klumpen der Amyloid- und Tau-Proteine bilden.
Noch bevor die ersten Symptome der Alzheimer-Demenz erkennbar sind, reichern sich im Gehirn der Betroffenen schon fehlgefaltete Amyloid-Beta- und Tau-Proteine an. Sie gelten als Auslöser für den Niedergang der Hirnzellen und die fortschreitenden geistigen Ausfälle. Typischerweise werden die für das Gedächtnis wichtigen Hirnareale im Schläfenlappen und angrenzenden Hirnbereichen als erste geschädigt, deshalb manifestiert sich Alzheimer meist zuerst durch Vergesslichkeit und Orientierungsprobleme.
Doch das ist nicht immer so: „Es gibt einige atypische Alzheimerfälle, in denen die Patienten erst Sprach- oder Sehstörungen entwickeln statt Gedächtnisprobleme“, erklärt Seniorautor Brian Gordon von der Washington University in Saint Louis. „Wenn man ihr Gehirn anschaut, sieht man Schäden in den Sprach- und Sehzentren, aber kaum in den Gedächtniszentren.“ Inzwischen lassen sich je nach Symptomatik und Ausbreitungsmuster der schädlichen Tau-Fibrillen vier Subtypen von Alzheimer unterscheiden.
Risikogene im Visier
Aber warum? Auf der Suche nach einem Faktor, der diese Unterschiede im Verlauf und den betroffenen Hirnregionen bestimmt, haben Gordon, seine Kollegin Aylin Dincer und ihr Team sich den wichtigsten genetischen Risikofaktor für Alzheimer näher angeschaut: Apolipoprotein-4 (APOE-4). Diese Variante eines eigentlich für die Regulation von Blutfettwerten zuständigen Gens fördert die Ablagerung von Amyloid-Plaques und kann das Risiko für Alzheimer um das bis zu Zwölffache erhöhen.
Unklar war aber bisher, welche Rolle dieses Gen für die Anreicherung der schädlichen Tau-Fibrillen im Gehirn der Betroffenen spielt – und ob es auch die räumlichen Muster von Alzheimer im Gehirn beeinflussen kann. Um das zu klären, haben Dincer und ihre Kollegen Symptome, Amyloid- und Tau-Verteilung sowie die Genaktivität von APOE-4 und weiteren Alzheimer-Risikogenen im Gehirn von 350 Testpersonen im Alter von rund 70 Jahren über vier Jahre hinweg untersucht.
Genaktivität beeinflusst Schadensbild
Das Ergebnis: APOE-4 und andere Alzheimer-Risikogene sind im Gehirn nicht überall gleich aktiv. Ihre Aktivität findet sich dort, wo sich dann auch die Alzheimer-Demenz als erstes manifestiert. „Es gab eine enge Übereinstimmung zwischen Stellen mit hoher APOE-Genexpression und denen, wo man Tau-Fibrillen und Zellschäden sah“, berichtet Gordon. Oft waren dies das Stirnhirn, der Schläfenlappen, der Hippocampus und die Amygdala – genau die Regionen, die bei den meisten Alzheimer-Patienten für die typischen Demenzsymptome verantwortlich sind.
Allerdings gab es auch Betroffene mit abweichendem Muster der Tau-Ablagerung und Genaktivität. „Es gibt offenbar fundamentale Unterschiede darin, welche Regionen für die alzheimertypischen Schäden anfällig sind, und diese Unterschiede werden wahrscheinlich durch die Genausstattung eines Menschen bestimmt“, sagt Gordon. Welche Kombinationen an Genvarianten dies im Einzelnen sind und warum, muss allerdings noch geklärt werden.
Offene Fragen bleiben
„Die Heterogenität verrät uns, dass es noch immer einiges zum Wie und Warum der Alzheimer-Entwicklung gibt, das wir nicht verstehen“, sagt Gordon. „Wenn wir jemanden sehen, der als erstes Frühzeichen Sehstörungen hat, stellt sich die Frage, welche spezifische Gensignatur dieses lokal spezifische Muster der Hirnschädigung auslöst.“ Er und sein Team wollen daher weiter erforschen, warum und wie sich die Muster der Risikogenaktivität bei Alzheimer-Patienten unterscheiden.
Ansatzpunkt für weitere Studien ist neben genaueren Daten zu den individuellen Unterschieden der Genexpression auch die Frage, welche Rolle die Dosierung von APOE-4- und anderen Genvarianten spielt: Je nach Vererbung kann ein Mensch eine oder zwei Kopien dieser Genvariante tragen. Dies beeinflusst auch das damit verknüpfte Risiko. Zudem wollen die Forschenden sich die Astrozyten genauer anschaue, die Hirnzellen, in denen APOE am aktivsten ist. Möglicherweise spielt auch ihre individuell unterschiedliche Verteilung eine Rolle für die räumliche Verteilung der Alzheimer-Herde im Gehirn. (Science Translational Medicine, 2022; doi: 10.1126/scitranslmed.abl7646)
Quelle: Washington University School of Medicine