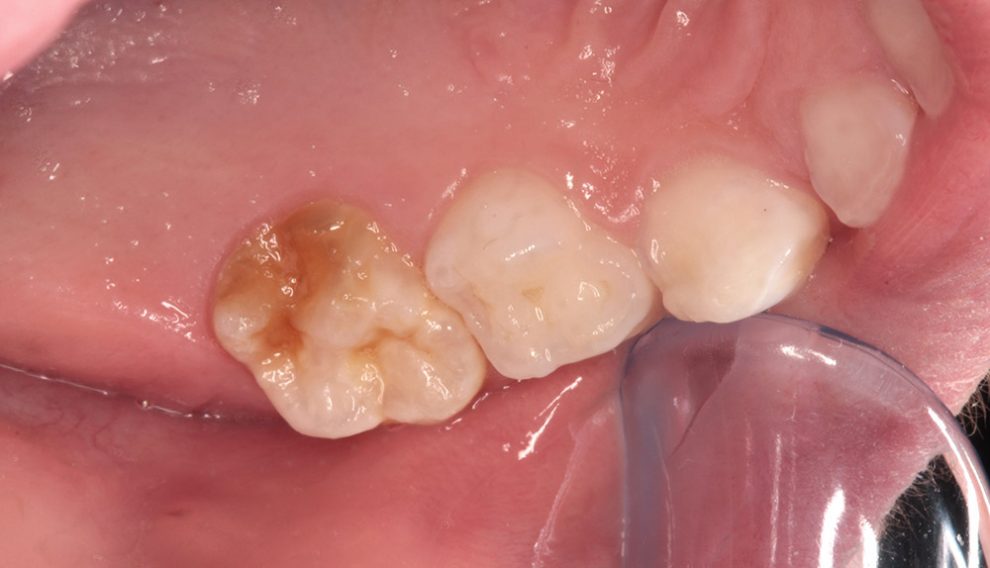
Blockierte Kristalle: Forscher könnten geklärt haben, wie die rätselhaften Kreidezähne bei Kindern entstehen – bräunlich verfärbte, unzureichend gehärtete Stellen im Zahnschmelz. Demnach liegt das Problem nicht in den schmelzproduzierenden Zellen, sondern im Zahnschmelz selbst. Bei Kreidezähnen lagert sich dort ein falsches Protein ein, das dann das Wachstum der Minerale behindert. Als Folge härtet der Zahnschmelz nicht richtig aus.
Die sogenannten Kreidezähne haben drastisch zugenommen: Inzwischen leidet schon jedes fünfte Kind unter den bräunlichen Verfärbungen und Schäden des Zahnschmelzes, bei den Zwölfjährigen ist sogar jedes dritte Kind betroffen. Weil die Mineral-Einlagerung in den Zahnschmelz gestört ist, bleibt diese harte Schutzschicht der Zähne weich. Gleichzeitig ist Zahnoberfläche rau und brüchig, wodurch sich besonders schnell Karies bilden kann.
Was aber ist die Ursache dafür? Bisher gibt es zwar mehrere „Verdächtige“, aber keine umfassende Erklärung für das Phänomen der Kreidezähne. So scheinen in einigen Fällen genetische Faktoren eine Rolle zu spielen, die die Mineralisation während der Zahnentwicklung stören. Aber auch Umweltfaktoren wie der Plastikzusatz Bisphenol A oder Antibiotika stehen im Verdach. Infekte im Kleinkindalter werden ebenfalls als mögliche Risikofaktoren diskutiert.
Überschüssiges Protein im Schmelz
Jetzt gibt es eine weitere Spur. Auf der Suche nach der Ursache der Kreidezähne haben sich Michael Hubbard von der University of Melbourne und seine Kollegen die Zahnschmelzbildung noch einmal näher angeschaut. Dabei wird zunächst das Protein Amelogenin von den schmelzbildenden Zellen produziert und bindet an die noch kleinen Mineralkristalle im Schmelz. Wenn dann der Zahnschmelz aushärtet, baut ein Enzym das Amelogenin ab und ermöglicht so das Wachstum der mineralischen Kristalle.
Doch bei den Kreidezähnen ist dies anders: Die weichen, verfärbten Stellen enthalten drei- bis 15-mal mehr Protein als für fertigen, ausgehärteten Zahnschmelz normal, wie die Forscher herausfanden. Offenbar wurde das Protein bei der Mineralisation des Schmelzes nicht abgebaut. Als Folge blockierten die überschüssigen Proteine das Wachstum der Mineralkristalle und damit das Aushärten des Zahnschmelzes.
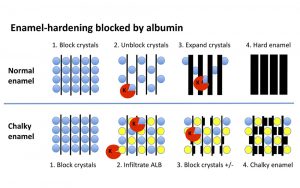
Serumprotein blockiert Mineralisierung
Aber warum werden die Proteine nicht entfernt? Um das herauszufinden, führten Hubbard und sein Team eine Proteinanalyse der defekten Zahnschmelzstellen durch – mit verblüffendem Ergebnis: „Überraschenderweise könnten wir darin nur geringe Spuren von Amelogenin finden“, berichten sie. Stattdessen enthielten die weichen Zahnschmelzstellen vermehrt das Serumprotein Albumin – ein Molekül, das in intaktem Zahnschmelz nicht vorkommt.
Für den Zahnschmelz hat dies Folgen: „Das Albumin imitiert Amelogenin, indem es sich an die unreifen Zahnschmelzkristalle anlagert“, erklären die Forscher. Weil das Albumin aber nicht durch die Enzyme im Schmelz wieder abgebaut werden kann, bleibt es vor Ort. „Das Ergebnis ist eine Blockade der Mineralisation, die aber auf lokale Bereiche beschränkt ist“, erklärt Hubbard. Das erklärt, warum nur einige Stellen der Zähne betroffen sind.
Indiz für frühkindlichen Auslöser
Sollte sich dies bestätigen, dann wirft dies ein neues Licht auf die tieferen Ursachen der Kreidezähne. Denn entgegen gängigen Annahmen liegt das Problem nicht in den schmelzproduzierenden Zellen des Zahns, sondern im Zahnschmelz selbst. „Damit korrigiert unsere Entdeckung 40 Jahre des zahnmedizinischen Dogmas, das diese Zellen die Schuld gab“, sagt Hubbard.
Gleichzeitig spricht die Präsenz des Serumproteins Albumin im krankhaft veränderten Zahnschmelz dafür, dass der Auslöser in der frühesten Kindheit liegen muss – zu der Zeit, in der noch unreifen Zähne aushärten. Das könnte ein Hinweis darauf sein, dass frühkindliche Infektionen eine Rolle spielen: „Die Epidemiologie hat bereits Indizien für eine Verbindung mit vorhergehenden Krankheiten erbracht, es fehlten aber die spezifischen Mechanismen“, so Hubbard und seine Kollegen.
Die jetzt identifizierte Einwanderung von Serum-Albumin und die daraus resultierende Blockade der Mineralisation könnten dieses fehlende Bindeglied liefern. „Aufbauend auf diesen Erkenntnissen können wir nun nach einer Strategie suchen, mit der wir dieses weltweite Problem vermeiden können“, sagt Hubbard. (Frontiers of Physiology, 2021; doi: 10.3389/fphys.2021.802833)
Quelle: Science in Public