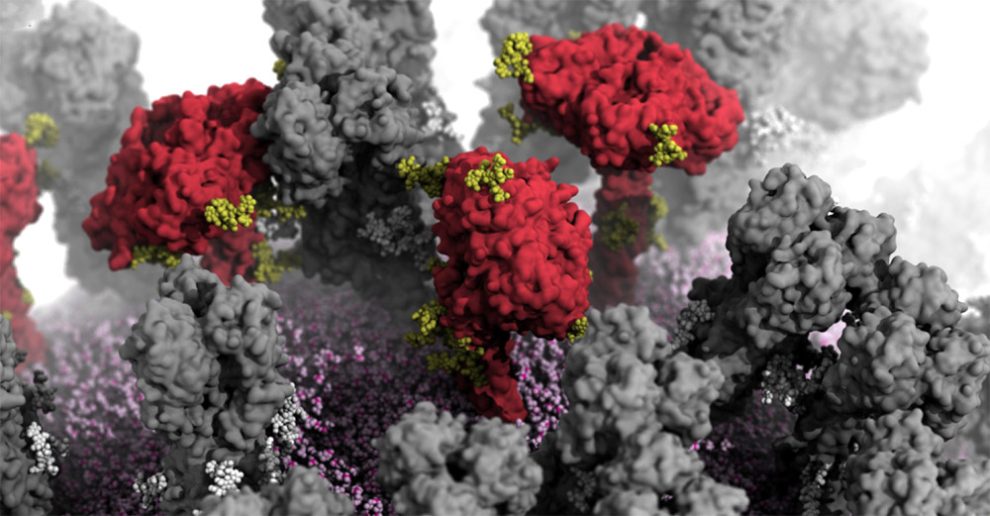
Verborgene Dynamik: Die Proteine auf der Oberfläche des Influenza-Virus sind überraschend beweglich, wie neue Analysen enthüllen. Demnach kann die virale Neuraminidase ihr „Köpfchen“ um fast 90 Grad abknicken und um seine Achse rotieren. Das zweite Protein, Hämagglutinin, zeigt dagegen eine überraschende „Atmung“: Sein dreizipfeliges Ende öffnet und schließt sich im Wechsel. Beide Bewegungsformen legen zuvor unerkannte Andockstellen für Antikörper frei – und haben damit Potenzial für die Medizin.
Das Grippevirus gehört zu den erfolgreichsten Erregern überhaupt: Immer wieder schafft es dieses behüllte RNA-Virus, Varianten zu bilden und sich an neue Wirte anzupassen. Dadurch entstehen regelmäßig neue Influenzavarianten, die Vögel befallen oder auf den Menschen überspringen können. Für deren Fähigkeit, dem Immunsystem auszuweichen und unsere Zellen zu infizieren, spielen die beiden aus der Hülle aufragende Oberflächenproteine Hämagglutinin (HA) und Neuraminidase (NA) eine entscheidende Rolle.
Wie diese Hüllproteine des Grippevirus aufgebaut und angeordnet sind, haben Virologen unter anderem mithilfe der Cryo-Elektronenmikroskopie weitgehend geklärt. Kaum bekannt war jedoch bisher, wie sich diese Virenproteine bewegen und welche Rolle dies für Infektion, Zelleintritt und den Erfolg unserer Immunabwehr spielt.
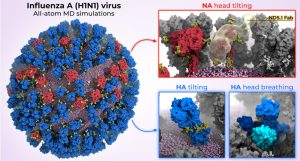
Ein Virus aus 160 Millionen Atomen
Genau dies haben nun Lorenzo Casalino von der University of California in San Diego und sein Team aufgeklärt. Auf Basis von elektronenmikroskopischen Daten und molekularen Analysen einzelner Proteindetails erstellten sie ein atomgenaues Modell des gesamten H1N1-Influenzavirus samt aller Hüllproteine. Das 3D-Modell umfasste mehr als 160 Millionen Atome, ihre Positionen und chemischen Bindungen.
In einer biophysikalischen Simulation ermittelten die Forschenden anschließend, wie sich die Hüllproteine unter In-vivo-Bedingungen verhalten und bewegen – beispielsweise, wenn sie in unsere Atemwege und Gewebe eingedrungen sind. „Unsere Simulationen liefern damit zuvor nie gesehene dynamische Ansichten der plastischen Konformitätsveränderungen der Hämagglutinin- und Neuraminidase-Anhänge“, so das Team.
Neuraminidase nickt mit dem Kopf
Tatsächlich enthüllten die Simulationen gleich drei überraschend dynamische Bewegungen der viralen Hüllproteine. Zum einen kann das Neuraminidase-Protein sein ausgeprägtes „Köpfchen“ um mehr als 90 Grad abknicken. Dadurch vollführt der Proteinkopf auf seinem Stiel kreisende Bewegungen. „Dieses Abknicken des Kopfes legt ein zuvor unbekanntes Epitop an der Unterseite des Neuraminidase-Kopfes frei“, berichten Casalino und seine Kollegen.
Das Spannende daran: Epitope sind potenzielle Andockstellen für Antikörper an den viralen Proteinen. Sie spielen daher eine entscheidende Rolle dafür, wie effektiv die Immunabwehr ein Virus erkennen und bekämpfen kann, aber auch, wie gut Impfstoffe und Antikörperpräparate wirken. „Wir haben bereits einen monoklonalen Antikörper identifiziert, der an der Unterseite des Neuraminidase-Kopfes binden kann“, berichten die Forschenden. Dies könnte neue Therapiemöglichkeiten eröffnen.
Neigung des Hämagglutinins legt „alte“ Andockstellen frei
Ähnliches gilt für die zweite in der Simulation identifizierte Protein-Bewegung. Denn auch das zweite Hüllprotein des Grippevirus, das Hämagglutinin, kann sein Endstück leicht neigen. Diese Stellung bleibt dabei längere Zeit erhalten – und legt gleich mehrere potenzielle Angriffsstellen frei: „Die graduelle Neigung der HA-Ektodomäne hat einen tiefgreifenden Einfluss auf die Zugänglichkeit der sogenannten ‚Anker-Epitope‘ am unteren Stielende des Proteins“, sagen Casalino und sein Team.
Diese tiefsitzenden Andockstellen gelten als wenig anfällig für Mutationen und bleiben bei vielen Influenza-Subtypen gleich. Dadurch können sie von breit wirksamen Antikörpern des Körpers oder eines Präparats angegriffen werden. „Wenn man die Hämagglutinin-Ektodomäne im geneigten Zustand festhält, könnte dies die Immunreaktion auf diese Anker-Epitope verstärken“, so die Forschenden. Tatsächlich existieren bereits mehrere breit neutralisierende Antikörper, die auf diese Andockstellen passen.
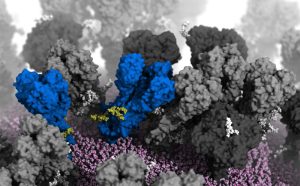
Der Proteinkopf „atmet“
Die dritte Bewegung ist deutlich ungewöhnlicher: Das Hämagglutinin-Protein „atmet“. Dabei öffnet und schließt sich das dreilappige Ende dieses Hüllproteins periodisch. „Die Proteinköpfe scheinen dabei asymmetrisch zu atmen, sie öffnen und schließen sich unabhängig voneinander“, berichten Casalino und seine Kollegen. Im Schnitt sind zu jeder gegebenen Zeit rund 70 Prozent der HA-Proteine eines Influenzavirus geschlossen, 30 Prozent offen.
Ähnlich wie die Knickbewegungen macht auch dieses Atmen des Hüllproteins das Grippevirus angreifbarer: Wenn sich der Kopf des Hämagglutinins öffnet, legt er in seinem Zentrum eine weitere potenzielle Andockstelle für Antikörper frei. Der Simulation zufolge passt dieses Epitop zu einem weiteren potenziell breitwirksamen Antikörper.
Potenzial für die Medizin
Nach Ansicht der Wissenschaftler haben diese neuen Einblicke in die Bewegungen der Influenza-Hüllproteine damit erhebliche Bedeutung für die Medizin. „Die in unseren Simulationen enthüllte Plastizität der Protein-Konformationen zeigt uns Schwachstellen des Virus und legt Epitope frei, die sonst versteckt oder nicht zugänglich wären“, erklären Casalino und seine Kollegen. Das eröffne neue Möglichkeiten, diese Stellen durch maßgeschneiderte Antikörper oder Impfstoffe anzugreifen.
Besonders relevant ist dabei, dass einige dieser potenziellen Andockstellen selbst bei der Bildung neuer Influenza-Varianten gleichbleiben. Das könnte es ermöglichen, Impfstoffe und Grippemittel zu entwickeln, die nicht in jeder neuen Saison angepasst werden müssen. (ACS Central Science, 2023; doi: 10.1021/acscentsci.2c00981)
Quelle: American Chemical Society