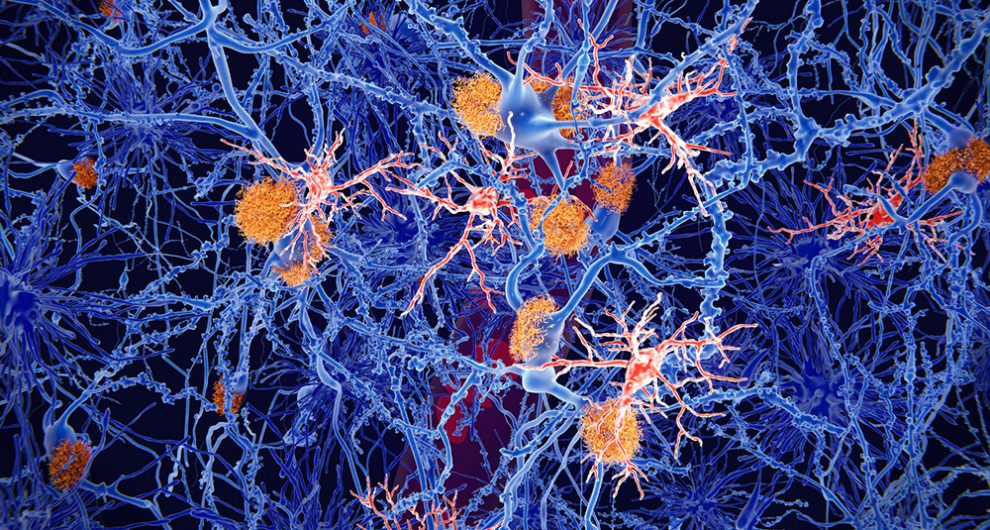
Überraschender Fund: Bei den für Alzheimer typischen Protein-Ablagerungen im Gehirn gibt es offenbar entscheidende Unterschiede, wie nun eine Studie enthüllt. Demnach sind die diffusen Ansammlungen des Amyloid-Beta-Proteins für Gehirnzellen tödlicher als Plaques mit dichtem, kompaktem Kern. Denn diese entstehen, wenn das hirneigene „Aufräum-Kommando“ die diffusen Ablagerungen gleichsam zusammenkehrt und so weniger schädlich macht.
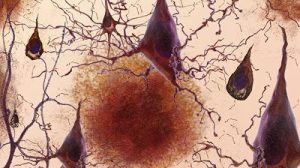
Als ein Kernmerkmal der Alzheimer-Demenz gilt die Ansammlung von unlöslichen Klumpen fehlgefalteter Amyloid-Beta-Proteine im Gehirn. Diese Plaques behindern gängiger Theorie nach den Hirnstoffwechsel und fördern das Absterben der Neuronen. Deshalb gelten die Plaques als vielversprechender Ansatzpunkt für Therapien gegen den fortschreitenden Hirnschwund. Bisher allerdings erbrachten Tests solcher Anti-Plaque-Wirkstoffe oft enttäuschende Ergebnisse.
Unterschied zwischen diffusen und dichten Plaques
Eine mögliche Erklärung dafür könnte nun ein Team um Youtong Huang vom Salk Institute for Biological Studies in Kalifornien gefunden haben. Denn nicht alle Amyloid-Plaques sind gleich. Eine Variante ähnelt diffusen Wolken aus lose verknäuelten Amyloid-Proteinfäden. Die zweite Plaque-Variante dagegen ist deutlich kompakter und besteht aus einem dichten Kern mit loserer Hülle. Bisher dachte man, dass beide Plaque-Formen von selbst entstehen und dann ihre schädliche Wirkung entfalten.
Doch in Versuchen mit Mäusen hat das Forschungsteam nun herausgefunden, dass dies so nicht stimmt. Zwar bilden sich die diffusen Plaques tatsächlich spontan aus den Vorläuferproteinen – das gilt aber nicht für die dichtere Variante. „Wir konnten zeigen, dass die Plaques mit dichtem Kern nicht spontan entstehen. Stattdessen werden sie von den Mikroglia-Zellen als Schutzmaßnahme gebildet – man sollte diese Plaques daher lieber in Ruhe lassen“, berichtet Seniorautor Greg Lemke vom Salk Institute.
Von Aufräum-Zellen kompaktiert
Konkret zeigte sich in den Experimenten, dass die dichteren Plaques im Rahmen des gehirneigenen „Aufräum-Programms“ entstehen. Dabei reagieren die Mikroglia – eine Art Hilfszellen des Gehirns – auf bestimmte Signalproteine der Neuronen: Sind diese geschädigt oder tot, tragen sie den sogenannten TAM-Rezeptor auf ihrer Oberfläche. Mithilfe eines weiteren Moleküls, Gas6, binden die Mikroglia dann an die tote Zelle und verschlingen sie – so werden Schäden und Abfälle entsorgt.
Wie Haung und seine Kollegen herausfanden, finden sich diese Signalmoleküle auch auf den alzheimertypischen Amyloid-Ansammlungen – und die Mikroglia reagieren darauf. Sie verschlingen die diffusen Plaques und wandeln sie in die kompaktere Aggregate um. Diese Plaques mit dichtem Kern erwiesen sich in Tests als weniger zellschädigend als ihre diffusen Vorläufer, wie die Forschenden berichten.
Diffuse Plaques sind schädlicher
„Wenn es mehr diffuse Plaques gibt, dann häufen sich dystrophische Neurite – Nervenzellausläufer, die neuronale Schäden anzeigen“, erklärt Huang. „Die dichten Plaques scheinen dagegen weniger schädlich zu sein: Wenn es weniger von ihnen gibt, nehmen die Zellschäden eher zu.“ Offenbar hilft die Verdichtung der Plaques durch die Mikroglia dabei, die schädlicheren diffusen Amyloid-Fäden zusammenzufassen und so den von ihnen verursachten Schaden zu begrenzen.
„Die Plaques mit dichtem Kern könnten einen Einkapselungs-Mechanismus repräsentieren – vielleicht analog zu den Granulomen bei Tuberkulose und anderen Infektionen“, schreibt das Team. Auch bei diesen Krankheiten versucht das Immunsystem, schädliche Erreger und ihre Produkte in einer Art Zysten einzuschließen und so zu isolieren. „Diese von Abwehrzellen vermittelte Kompaktierung könnte auch die Verbreitung von toxischen Amyloid-Beta-Oligomeren im Gehirn begrenzen“, so Huang und seine Kollegen.
Plaques verhindern statt zerstören
Das könnte auch erklären, warum einige gegen Alzheimer getestete Therapeutika wenig wirksam sind: Wenn sie vornehmlich die dichten Amyloid-Plaques angreifen und beseitigen, konterkarieren sie die Aufräumarbeiten der Mikroglia. Die Mittel behindern also gehirneigene Schutzmechanismen gegen die Demenz. „Es sind verschiedene Antikörper in Zulassungstests, deren Hauptwirkung die Verringerung der dichten Amyloid-Plaques ist“, sagt Lemke. „Aber unseren Erkenntnissen nach könnte das Aufbrechen dieser Ablagerungen nur noch mehr Schaden anrichten.“
Nach Ansicht der Wissenschaftler sollten sich künftige Therapien daher weniger darauf konzentrieren, schon existierende Plaques zu zerstören. Stattdessen halten sie es für sinnvoller, schon die Bildung der unlöslichen Amyloid-Beta-Proteine zu verhindern oder aber ihre natürliche Entsorgung anzukurbeln.
Ansätze für neue Therapien
Ansatzstellen dafür könnte die Signalmoleküle TAM und Gas6 bieten: In den Tests zeigten Mäuse mit einem Mangel an diesen Signalproteinen eine deutlich geringere Aktivität der abfallentsorgenden Mikroglia. In ihren Gehirnen reicherten sich dadurch vor allem die besonders schädlichen diffusen Amyloid-Ablagerungen an, wie die Forschenden berichten.
Nutzt man nun Wirkstoffe, die die Expression von TAM und Gas6 hochregulieren, dann könnte dies zumindest einen Teil der Amyloid-Schadwirkung mindern. Erste Studien dazu sind bereits in Planung. (Nature Immunology, 2021; doi: 10.1038/s41590-021-00913-5)
Quelle: Salk Institute for Biological Studies