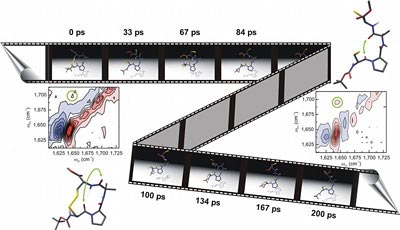
Proteine schaffen es, ihre Struktur und damit auch ihre Funktion in Sekundenbruchteilen zu verändern. Mithilfe einer neuen Technik ist es Züricher und Bochumer Forschern nun erstmals gelungen, diese sehr schnellen Bewegungen von Peptiden – kurzen Proteinstücken – zu filmen.
Die Methode erlaubt es darüberhinaus zu bestimmen, ob zwei molekulare Gruppen im Peptid zu einem bestimmten Zeitpunkt benachbart sind oder nicht und eignet sich daher für die experimentelle Überprüfung von theoretischen Modellen. Über ihre Ergebnisse berichten die Forscher in der aktuellen Ausgabe des Wissenschaftsmagazins Nature.
Zahnräder der molekularen Maschinen
Proteine sind die Bausteine des Lebens. Meistens weisen sie eine wohldefinierte dreidimensionale Struktur auf, die jedoch alles andere als statisch ist: Proteine sind hochdynamische Objekte, die ihre Arbeit als 'molekulare Maschine' verrichten. Sie ändern fortwährend ihre Struktur, binden an andere Stoffe und transportieren diese zu ihrem Bestimmungsort, oder sie steigern die Effizienz bestimmter chemischer Reaktionen.
Gäbe es ein Mikroskop, mit dem man ein Protein sichtbar machen könnte, so würde man feststellen, dass einzelne Atome oder Molekülgruppen innerhalb des Proteins – die "Zahnräder" der molekularen Maschine – sich auf einer unvorstellbar kurzen Zeitskala von wenigen Pikosekunden (0,000 000 000 001 Sekunden) bewegen.
"Licht, das die Strecke von der Erde zum Mond innerhalb einer Sekunde zurücklegen kann, schafft es in dieser kurzen Zeit von einer Pikosekunde gerade einmal 0,3 mm weit; das entspricht in etwa der Dicke von drei Blatt Papier", verdeutlicht Professor Wolfram Sander von der Ruhr-Universität Bochum (RUB), der zusammen mit seinem Kollegen Professor Peter Hamm von der Universität Zürich für die neuen Forschungsergebnisse verantwortlich ist. Man glaubt, sehr viel über diese schnelle Dynamik aus theoretischen Berechnungen zu wissen – deren experimentelle Beobachtung und Verifizierung erweist sich jedoch als extrem schwierig.
"Film" mittels 2D-Spektroskopie
Den Forschern ist es nun gelungen, die superschnelle Veränderung eines kleinen Peptids sichtbar zu machen. Sie "filmten" buchstäblich das Peptid, während es sich von einer Struktur in eine andere umwandelte.
Verwendung fand hierbei eine neuartige spektroskopische Methode, die so genannte zweidimensionale Infrarotspektroskopie. Diese ermöglicht es zu bestimmen, ob zwei molekulare Gruppen im Peptid zu einem bestimmten Zeitpunkt räumlich benachbart sind oder nicht. "Diese Technik eröffnet ein neues, bisher unzugängliches Zeitfenster für die Beobachtung der Strukturdynamik von Biomolekülen und erlaubt deshalb eine sehr direkte experimentelle Verifizierung theoretischer Modelle", erläutert Sander.
(idw – Ruhr-Universität Bochum (RUB), 23.11.2006 – DLO)