Allgegenwärtiger Akku: Der Nobelpreis für Chemie 2019 geht an drei Forscher, denen wir die Lithiumionen-Batterie verdanken – den Akku, der heute in jedem Handy, jedem Laptop und unzähligen weiteren elektronischen Geräten steckt. Der US-Forscher Stanley Whittingham entwickelte die erste Lithium-Batterie, sein US-Kollege John Goodenough optimierte die Kathode und der Japaner Akira Yoshino ersetzte erstmals das metallische Lithium der Anode durch Lithiumionen.
Sie stecken in Handys, Notebooks und Kameras, aber auch in Elektroautos oder der Elektronik von Flugzeugen: Lithiumionen-Akkus bilden die Grundlage fast aller mobilen Stromspeicher der modernen Technikwelt. Denn diese Akkumulatoren sind leicht, besitzen aber trotzdem eine relativ hohe Energiedichte und können unzählige Male auf- und wieder entladen werden. Die drei Preisträger des diesjährigen Chemie-Nobelpreises haben jeweils entscheidende Beiträge zur Entwicklung dieser allgegenwärtigen Stromlieferanten geleistet.
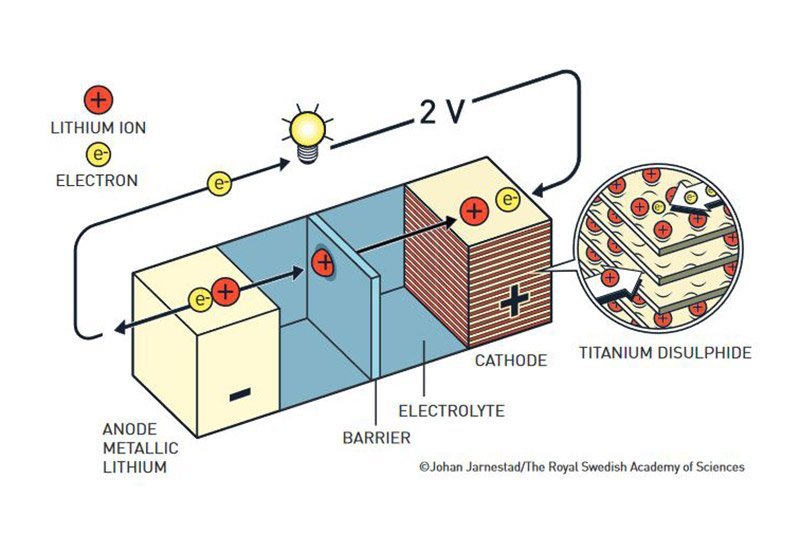
Whittingham: die erste Lithiumbatterie
Den Anfang machte Stanley Whittingham Anfang der 1970er Jahre – zur Zeit der Ölkrise. Der damals vom Ölkonzern Exxon angestellte Forscher suchte daher nach Materialien, mit denen sich Stromspeicher für künftige elektrisch angetriebene Fahrzeuge produzieren ließen. Whittingham stellte fest, dass die Verbindung Tantaldisulfid sehr energiereich ist und bei Reaktion mit Kaliumionen einige Volt Strom erzeugen kann.
Ausgehend von dieser Entdeckung entwickelte Whittingham die erste Lithiumbatterie: Er nutzte Tantaldisulfid als Kathode, benötigte nun aber noch einen Elektronenspender für die Anode seiner Batterie. Er wählte dafür Lithium, ein sehr reaktionsfreudiges Alkalimetall, das in chemischen Reaktionen sehr leicht ein Elektron an seine Bindungspartner abgibt.
Das Ergebnis dieser Entwicklung war eine wiederaufladbare Batterie, die zwei Volt Spannung erzeugen konnte. Als Whittingham seinem Arbeitgeber Exxon die neue Lithiumbatterie vorstellte, war dieser angetan und begann mit der Produktion des Akkus in kleinen Stückzahlen – unter anderem für einen Schweizer Uhrenhersteller. Das Ende der Ölkrise allerdings führte dazu, dass Exxon das Interesse an Stromlieferanten für potenzielle Elektroautos wieder verlor.
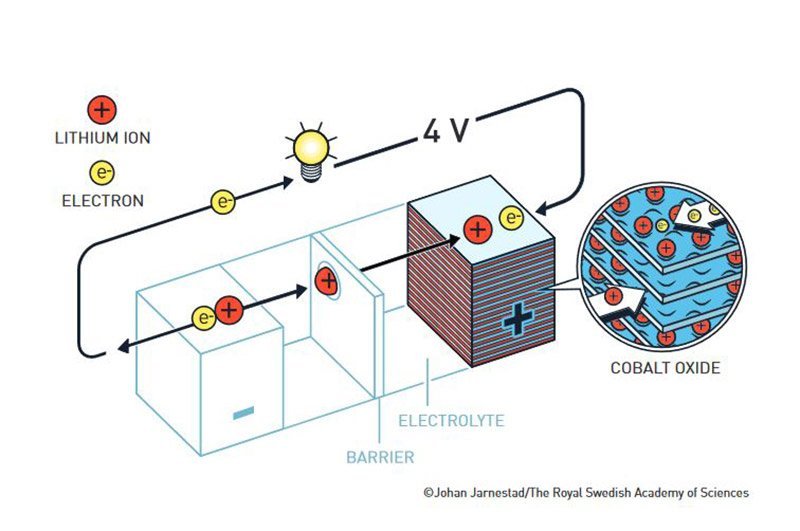
Goodenough: Metalloxid statt Sulfid
Den nächsten Schritt in der Entwicklung vollführte der zweite Preisträger, John Goodenough. Während seiner Zeit an der University of Oxford nutzte der US-Forscher sein Wissen über Feststoffe, um Whittinghams Batterie weiter zu verbessern. Er tauschte die Tantadisulfid-Kathode gegen eine Elektrode aus Lithium-Kobaltoxid, denn er hatte erkannt, dass Metalloxide eine höhere Energiedichte besitzen als die Sulfide.
1980 veröffentlichte Goodenough das Konzept dieser weiterentwickelten Lithiumbatterie. Statt der zuvor zwei Volt Spannung konnte dieser Akku vier Volt produzieren – doppelt so viel wie Whittinghams Modell. Doch auch seine Batterie konnte sich angesichts günstiger Ölpreise und der noch nicht begonnenen Ära der mobilen Geräte nicht durchsetzen.
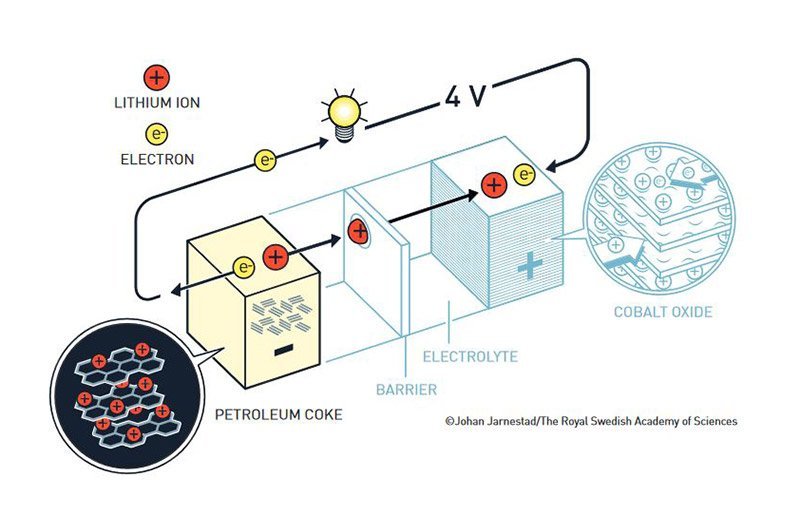
Yoshino: Der Lithiumionen-Akku
Den entscheidenden Schub erhielt die Lithiumbatterie durch den dritten Preisträger, Akira Yoshino von der Asahi Kasei Corporation in Tokio. Mitte der 1980er Jahre suchten Elektronikfirmen in Asien nach einer Möglichkeit, die von ihnen entwickelten Videokameras, Telefone und Computer auch kabellos mit Strom zu versorgen. Yoshino nutzte dafür Goodenoughs Version der Lithium-Kobaltoxid-Batterie, wollte aber die Anode leistungsfähiger und sicherer machen. Denn das metallische Lithium dieser Elektrode neigte dazu, sich im Laufe der Zeit zu verändern und dies konnte gefährliche Kurzschlüsse hervorrufen.
Yoshino entschloss sich daher, statt des metallischen Lithiums ein kohlenstoffhaltiges Material für die Anode zu nutzen. In seinen Tests erwies sich dann Petrolkoks, ein aus Erdöl gewonnener Feststoff, als geeignetes Elektrodenmaterial. Für seine Batterie verwendete der Forscher das Lithiumionen-haltige Petrolkoks als Anode, die Lithium-Kobaltoxid-Kathode von Goodenough und einen lithiumhaltigen Elektrolyten.
Damit war die Lithiumionen-Batterie geboren. Yoshinos neuer Akku erzeugte eine Spannung von vier Volt und wies eine Energiedichte von 80 Wattstunden pro Kilogramm auf – mehr als jeder andere Akku dieser Zeit. Durch den Verzicht auf metallisches Lithium erweis sich diese Batterie zudem als deutlich sicherer und weniger explosionsanfällig als die früheren Versionen.
„Der Menschheit einen großen Dienst erwiesen“
Bereits 1991 begann ein erster Elektronikkonzern damit, mobile Geräte mit diesen neuen Lithiumionen-Akkus zu produzieren und zu verkaufen. Seither ist diese Batterie aus Technik und Alltag nicht mehr wegzudenken. „Durch ihre Arbeit haben John Goodenough, Stanley Whittingham und Akira Yoshino die richtigen Bedingungen geschaffen, um eine kabellose und von fossilen Energieträgern freie Gesellschaft zu ermöglichen“, heißt es in der Erklärung des Nobelpreiskomitees. „Sie haben damit der Menschheit einen großen Dienst erwiesen.“
Allerdings haben auch die heutigen Lithiumionen-Batterien ihre Grenzen – so nimmt beispielsweise ihre Leistung nach vielen Ladezyklen ab und bei Überhitzung können die Akkus explodieren. Deshalb arbeiten Forscher weltweit an weiteren Optimierungen der Lithiumionen-Akkus, aber auch an Batterien auf Basis anderer Materialien wie beispielsweise Natrium. Auch Batterien mit metallischem Lithium sind wieder in der Diskussion, weil sie eine noch höhere Energiedichte erreichen können. Bisher allerdings sind diese potenziellen Alternativen zur Lithiumionen-Batterie erst im Entwicklungsstadium.
Quelle: Nobelprize.org















