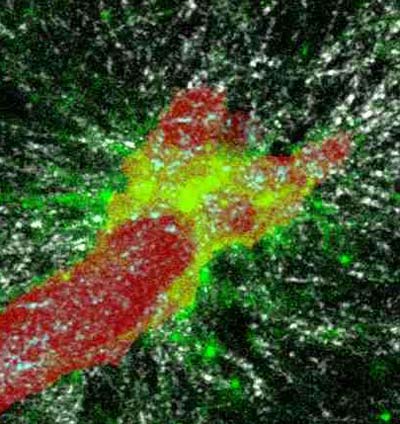
Wie Tumorzellen, ja sogar ganze Tumore sich im Körper ausbreiten ist jetzt erstmals an einem dreidimensionalen Modell zu sehen. In mehreren Filmen zeigen Forscher, wie sich die Tumore ihren Weg durchs Gewebe bahnen. Die jetzt in „Nature Cell Biology“ veröffentlichten Ergebnisse tragen dazu bei, das grundlegende Verständnis für die Therapie von Tumorerkrankungen zu verbessern.
{1l}
Tumorbewegung bisher unerforscht
Die frühzeitige Entdeckung eines Tumors ist nach wie vor die wichtigste Vorsorge bei Krebs. Wie schnell sich aber ein Tumor im Körper ausbreitet und wie man ihn daran hindern kann, darüber gibt es bisher jedoch nur wenig Kenntnis. Welche molekularen Helfer die Zelle hat, um sich im Gewebe fortzubewegen, ist zwar seit längerem bekannt: Integrine, mit denen sich die Zelle am Gewebe festhält und Proteasen, die das Gewebe zerschneiden, sind die wichtigsten. Wie der gesamte Bewegungsablauf in einem echten drei-dimensionalen Gewebe abläuft, wusste jedoch niemand.
„Wir konnten uns bisher zwar ungefähr vorstellen, wie sich die Tumorzellen im Gewebe bewegen. Um aber den genauen Bewegungsablauf zu verstehen, ist es unbedingt nötig, die Zellen in einem drei- dimensionalen Gewebe zu beobachten. Dort haben sie nämlich ganz andere Hindernisse“, so Prof. Dr. Peter Friedl, Forscher am Rudolf-Virchow- Zentrum/DFG Forschungszentrum der Universität Würzburg.
„Klettern“ im Gewebenetz
So ließen Versuche im Reagenzglas beispielsweise annehmen, dass die Tumorzellen mit ihren Armen nicht nur zugreifen, sondern gleichzeitig den Weg wie eine Art Bagger für den nachfolgenden dickeren Zellkörper freimachen. Das wäre allerdings so, als würde man den Ast, auf dem man sitzt, absägen, denn nachkommende Massen oder auch nur die hinteren Enden der Zelle könnten sich dann nicht mehr festhalten. „In unseren Filmen ist ganz deutlich zu sehen, dass erst dort Gewebe zerschnitten wird, wo es für die Zelle zu eng wird. Danach wird ein Teil der losen Enden wieder zusammengeflickt, damit die hinteren auch noch Gewebe zum Abstützen haben“, berichtet Friedl.
Das Modell zeigt, dass Tumorzellen in lebenden Geweben wandern wie ein Kletterer am Berg. Mit kleinen Greifarmen heften sie sich an das Gewebe und ziehen sich daran entlang. Doch das ist nicht die ganze Geschichte. Eigentlich ist das Gewebe eher ein festes Netz, das sich oben, unten und seitlich um die Tumorzellen herumspannt – und ist damit für die Zellen viel zu dicht, um sich darin frei bewegen zu können. Also schneiden sich die Zellen mit molekularen Helfern ständig das Netz zurecht, bilden einen kleinen Pfad und bauen die losen Netzenden wieder so zusammen, dass sie sich mit ihren „Füßen“ daran abdrücken können.
Tumormassen in Bewegung
Dramatischer wird es, wenn sich eine ganze Tumormasse im Kollektiv ihren Weg durch das Gewebe bahnt. Dann wird aus dem kleinen Pfad eine riesige Röhre, in deren Inneren mehrere Zellen nebeneinander Platz haben. Wie die molekularen Helfer diese Wanderung ganzer Tumormassen ermöglichen, war zuvor nicht bekannt – obwohl Histologen schon länger wissen, dass Tumorzellen bevorzugt in ganzen Zellmassen wandern. Gemeinsam mit Dr. Katarina Wolf entwickelte Friedl speziell für das neue Modell eine Art Ersatzgewebe, Kollagen aus Rindern, in dem sich ein künstlich erzeugter Tumor wie im lebenden Körper ausbreiten kann – in drei Dimensionen. Mit neuen Methoden können sie nun das gesamte Gewebe, dessen Auf- und Umbau und die einzelnen molekularen Helfer erstmals zusammen in zeitlicher Folge sichtbar machen können. Biochemie live unter dem Mikroskop sozusagen.
Nach dem großen Erfolg überprüfen die Forscher nun die Gültigkeit des Modells direkt im lebenden Organismus. Die Versuche laufen, erste Ergebnisse bestätigen bereits die Übertragbarkeit der Daten. Lassen sich Peter Friedls Ergebnisse übertragen, könnte man mit der Methode diesen Fragen direkt im lebenden Organismus auf die Spur kommen.
Die Forschungen liefen in Kooperation mit Jörg Geiger vom Institut für Klinische Biochemie und Pathobiochemie, Yi Wu, Yueying Liu und Sharon Stack von der Northwestern University Feinberg Medical School, Chicago, sowie Eric Tam und Christopher Overall von der University of British Columbia, Vancouver.
(Universität Würzburg, 09.07.2007 – NPO)