Fehlgefaltete Prionen lösen Krankheiten wie den Rinderwahnsinn oder die Creutzfeldt-Jakob-Krankheit aus. Was diese Erreger aber so giftig für die Gehirnzellen macht, war bisher unklar. Jetzt haben Schweizer Forscher dieses Rätsel gelöst: Es ist demnach der flexible Schweif des Prion-Proteins, der die Zelltötung auslöst. Das aber bedeutet, dass nur die Mittel gegen Prion-Erkrankungen wirken, die sich gegen diesen Schweif richten, wie die Forscher im Fachmagazin „Nature“ berichten.
Prionen sind Proteine, die natürlicherweise in den meisten Organismen vorkommen, so auch beim Menschen – beispielsweise in den Hirnzellen. Kommen sie aber in Kontakt mit fehlgefalteten Prionen, verändern sie ebenfalls ihre Form und werden dann zu schädlichen Krankheitsauslösern: Sind sie in größerer Menge im Gehirn präsent, lassen sie Hirnzellen absterben. Die Folge sind unter anderem Krankheiten wie der Rinderwahnsinn (BSE) oder die die Creutzfeldt-Jakob-Krankheit.
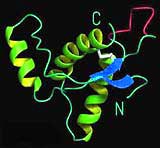
Warum das veränderte Prion für Hirnzellen giftig ist, blieb jahrzehntelang ungelöst. Adriano Aguzzi, Neuropathologe an der Universität Zürich und am Universitätsspital Zürich, und sein Team haben nun genauer untersucht, warum diese Verformung ungesund ist. Dafür züchteten sie in Gewebeschnitten aus dem Hirn von Mäusen gezielt genau die Antikörper, die an den gleichen Andockstellen der Zellen ansetzten wie die Prionen und dadurch die Hirnzellen vergifteten. Auf diese Weise konnten sie aufklären, welche Komponente der Prionen für die Giftwirkung verantwortlich ist. Dabei zeigte sich: Das Prion-Protein-Molekül besteht aus zwei unterschiedlichen Teilen: einer Art rundlichen Kopf und einem langen, flexiblen Schwanz. Unter normalen Bedingungen ist dieser Schweif sehr wichtig, um die Funktion von Zellen aufrechtzuerhalten. Bei einer Infektion mit schädlichen Prionen oder durch Anlagerung bestimmter Antikörper reagieren diese mit dem Kopf der normalen Prionen und verändern deren Schweif so, dass er die Zellen nun schädigt. „Dieser flexible Schweif ist für die Ausführung der Zelltötung verantwortlich“, erklärt Aguzzi.
Zelltod kann verhindert werden
Und noch etwas entdeckten die Forscher: „Prion-Proteine ohne den langen Schweif können die Hirnzellen nicht mehr schädigen“, so der Wissenschaftler. Wird der Schweif mittels eines weiteren Antikörpers gebunden und unzugänglich gemacht, löst er auch nach Aktivierung des Schalters keinen Zelltod mehr aus.
„Unsere Entdeckung hat weitreichende Konsequenzen für das Verständnis von Prion-Erkrankungen“, so Aguzzi. Die Ergebnisse enthüllen, dass nur jene Antikörper, die sich gegen den Schweif des Prion-Proteins richten, als potentielle Arzneimittel geeignet sind. Und: Antikörper, die am Schalter des Prions andocken und ihn so aktivieren, sind sogar schädlich und gefährlich. Bei der Auswahl eines geeigneten Medikaments muss man also sehr vorsichtig sein, ansonsten wird die Krankheit sogar beschleunigt. (Nature, 2013; doi: 10.1038/nature12402)
(Universität Zürich, 01.08.2013 – SEN)