Eine effektive Müllentsorgung ist nicht nur in der menschlichen Gesellschaft sondern auch im Körper aller Organismen wichtig. Jetzt haben Wissenschaftler herausgefunden, wie Bakterien ihren Proteinmüll in der Zellhülle unschädlich machen: Ein wie ein kleiner Käfig geformtes Enzym zerlegt die Moleküle in ungefährliche Bruchstücke.
Defekte und überzählige Proteine in und außerhalb von Zellen können extrem gefährlich für den Organismus sein. Da Proteine, die Ihre Funktionstüchtigkeit verloren haben, dazu neigen mit anderen Eiweißmolekülen zu großen Aggregaten zu verklumpen, können sie die lebenswichtigen Zellfunktionen erheblich stören. In den verschiedenen Bereichen der Zelle und auch außerhalb der Zelle gibt es deshalb spezielle Enzyme, die den Eiweißschrott erkennen und unschädlich machen: die sogenannten Proteasen.
Sowohl bei den kleinsten einzelligen Organismen wie beispielsweise Bakterien als auch beim Menschen gibt es eine ganze Gruppe von diesen Müll-Entsorgungs Molekülen. Ist die Funktion von Proteasen lahmgelegt, so kann dies zu schwerwiegenden Erkrankungen wie Parkinson oder Alzheimer führen. Während die Arbeitsweise von vielen Proteasen innerhalb der Zelle gut charakterisiert ist, ist die Qualitätskontrolle von Proteinen außerhalb der Zelle noch wenig erforscht.
Enzym erkennt „gute“ und „schädliche“ Proteine
Ein Team von Forschern aus Wien, Martinsried, Cardiff und Duisburg- Essen hat jetzt die Protease Funktion von DegP untersucht, welches in der Zellhülle von Bakterien, also außerhalb der Zelle, eine wesentliche Rolle bei der Entsorgung von defekten Proteinen spielt.
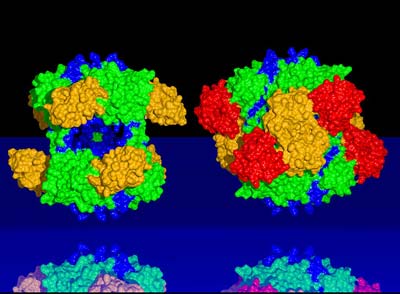
„Das DegP ist ein ganz besonderes Molekül, weil es nicht nur über eine Protease-Funktion verfügt und defekte Proteine vernichtet, sondern auch intakte Proteine erkennt“, so Professor Ehrmann, Mitverfasser der Studie und Vorstandsvorsitzender des Zentrums für Medizinische Biotechnologie in Duisburg-Essen. „Die gesunden Proteine werden wie in einem Käfig beschützt und sicher an ihren Bestimmungsort transportiert“. Bereits 2002 hatten die Forscher die molekulare Struktur des Moleküls aufgeklärt und sowohl dessen Reparatur- als auch die Proteasefunktion beschrieben.
Auf welche Weise dieses intelligente Molekül gesunde von defekten Proteinen unterscheidet, haben die Forscher jetzt im Detail untersucht. Sie haben dabei einen neuen Mechanismus entdeckt, der wahrscheinlich auch auf menschliche Proteasen übertragbar ist, die außerhalb der Zelle arbeiten. Bei der Bindung von defekten Proteinen an dem „Eingangstor“ des DegP-Käfigs verändert sich im
Innern des Moleküls das Reaktionszentrum derart, dass die Protease-Aktivität in Gang gesetzt wird. Das gesamte Reaktionszentrum bleibt solange aktiv, bis das defekte Protein vollständig abgebaut ist. Dabei wird das Protein in regelmäßigen Abständen, wie mit einem Lineal vermessen, in kleine Bruchstücke zerkleinert.
„Für den Organismus ist es wichtig, dass defekte Proteine so schnell wie möglich beseitigt werden“, so Tim Clausen vom Institut für Molekulare Pathologie in Wien. „Wir haben beobachtet, dass, sobald der erste Schnitt in das defekte Protein gesetzt wurde, die nachfolgende Verdauung sich rasant beschleunigt.“ Nach dem erfolgreichen Abbau verlassen die kleinen, ungefährlichen Bruchstücke den DegP-Käfig, und die Protease-Aktivität wird wieder abgeschaltet.
Neuer Ansatzpunkt für Therapien
Die neuen Forschungsergebnisse können nun die Entwicklung von Therapeutika beispielsweise für Parkinson und Alzheimer erleichtern. Die bakterielle Protease DegP gehört zur Proteinfamilie der sogenannten HtrA Proteasen, die beim Menschen in Verbindung diesen beiden Krankheiten gebracht werden.
„DegP zeigt uns ganz neue Strategien, die Proteasemaschinen mit kleinen gezielt synthetisierten Molekülen zu aktivieren und diese schrecklichen Krankheiten zu mildern“ meint Nobelpreisträger Robert Huber, der am Max-Planck-Institut für Biochemie in Martinsried und ZMB der Universität Duisburg-Essen forscht.
(Max-Planck-Institut für Biochemie, 30.05.2008 – NPO)