Wenn Zellen in Stress geraten, leistet das Eiweiß Hsp90 einen wichtigen Beitrag dazu, dass sie überleben. Münchener Forscher haben die Arbeitsweise dieses Proteins bereits vor einiger Zeit aufgeklärt – doch nun hat Hsp90 mit einem unerwarteten Bewegungsmuster in Form einer Wippbewegung selbst die Experten überrascht.
Wie die Forscher der Technischen Universität München (TUM) in der aktuellen Online-Ausgabe des Wissenschaftsmagazins „PNAS“ schreiben, könnten ihre Ergebnisse helfen, ein spezifisches Medikament gegen Krebs zu finden.
Maschinen der Zelle
Proteine sind die Maschinen der Zelle: Sie transportieren zum Beispiel Nährstoffe, bewegen unsere Muskeln, wandeln Stoffe chemisch um oder falten andere Proteine. Das so genannte Hitzeschockprotein Hsp90 ist für unsere Zellen von zentraler Bedeutung, da es viele Basis-Prozesse entscheidend steuert – bei uns genauso wie in Bakterien oder Hefen. Es ist etwa maßgeblich daran beteiligt, dass einfache Aminosäureketten zu funktionierenden Proteinen mit einer genau definierten räumlichen Struktur gefaltet werden.
Vor allem dann, wenn die Zelle durch Hitze, Vergiftungen oder Sauerstoffmangel hohem Stress ausgesetzt ist, wird HSP 90 vermehrt hergestellt, um die Schäden in Grenzen zu halten.
Scherenartiges Verhalten in Echtzeit verfolgt
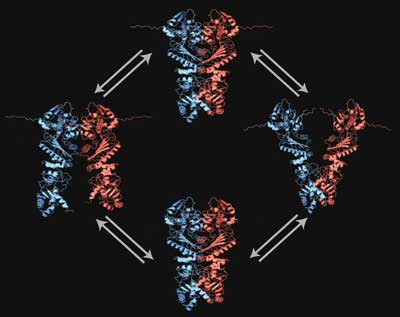
Das Antistress-Protein ist ein Dimer, es besteht also aus zwei identischen Teilen, und kann grob in drei Abschnitte eingeteilt werden: oben der N-Terminus, dann die Mitteldomäne und unten der C-Terminus. Die notwendige Energie für seine Funktion gewinnt Hsp90 durch die langsame Spaltung von ATP, dem Treibstoff jeder Zelle. Dabei bewegen sich die beiden Stränge gegeneinander, allerdings nur um einige Nanometer.
TUM-Wissenschaftler um Professor Johannes Buchner aus der Chemie und Professor Thorsten Hugel aus der Physik kennen die Hsp90-Bewegung eigentlich gut: Sie waren die ersten, die das scherenartige Verhalten in Echtzeit verfolgt haben. Doch nun waren auch sie überrascht: Denn anstatt der bekannten, einseitigen Scherenbewegung am N-Terminus konnten sie nun eine doppelseitige Wippbewegung nachweisen.
Farbstoffmoleküle als molekulares Lineal
Auch am C-Terminus bewegt sich das Hsp90 scherenartig auf und zu – so etwas war bisher bei Dimeren nicht bekannt. Für ihre neue Beobachtung griffen die Forscher auf die so genannte FRET-Technik – FRET = Förster Resonance Energy Transfer – zurück.
Sie haben zwei fluoreszierende Farbstoffmoleküle an exakt definierten Stellen im Hsp90 angebracht und als molekulares Lineal benutzt: Beleuchtet man einen Farbstoff, so bringt dieser den zweiten Farbstoff umso heller zum Leuchten, je näher er an diesem ist. So konnten die Forscher unter einem eigens dafür gebauten Spezialmikroskop die doppelte Scherenbewegung im Nanometerbereich an einzelnen Hsp90-Dimeren sehen.
Doppelte Scherenbewegung
Besonders interessant ist nach Angaben der Wissenschaftler, dass die doppelte Scherenbewegung am N- und C-Terminus eng gekoppelt ist: Das Hsp90-Dimer öffnet sich wechselseitig auf der einen oder anderen Seite, wie eine Wippe. „Dies erklärt die hohe Stabilität des Dimers – sonst würde so ein Antistress-Protein viel schneller auseinanderfallen“, erklärt Hugel.
Sehr überrascht hat sein Team auch die Regulation der Geschwindigkeit dieser Wippbewegung: Denn verantwortlich für die Regulation der Schere am C-Terminus ist die ATP-Bindung, die am N-Terminus stattfindet. Das konnten die Forscher nachweisen, indem sie dem Dimer die Energiezufuhr ATP abdrehten. Die Schlussfolgerung des Teams: Hsp90 kommuniziert intern über ungewöhnlich weite Strecken – fast zehn Nanometer.
Ergebnisse wichtig für die Grundlagenforschung
Das beobachtete Bewegungs- und Kommunikationsmuster ist für die Grundlagenforschung interessant, aber gleichzeitig auch für die Pharmaindustrie: Denn Hsp90 gilt als vielversprechender Ansatzpunkt für die Krebstherapie. Bisher aussichtsreiche Medikamente blockieren am N-Terminus des Antistress-Proteins die Aufnahme von ATP. Dabei wird jedoch gleichzeitig auch bei anderen Proteinen die Energiezufuhr behindert – ungewollte Nebenwirkungen sind die Folge.
Dank ihrer neuen Erkenntnisse können sich die TUM-Forscher nun
auf den C-Terminus von Hsp90 konzentrieren: „Dort gibt es einzigartige Andockstellen für Krebsmedikamente, die eine Wirkung ohne Nebeneffekte haben sollten“, hofft Hugel.
Film zur neu entdeckten Wippbewegung von Hsp90
(idw – Technische Universität München, 24.08.2010 – DLO)