Es ist fast schon ein unglaublicher Zufall: Als nach dem Urknall die ersten Atome entstanden, gab ihnen die Natur eine entscheidende Fähigkeit mit: Dank ihres Aufbaus aus Atomkern und Elektronenhülle konnten die ersten Materiebausteine miteinander wechselwirken. Anfangs gab es zwar kaum mehr Auswahl als Wasserstoff, Helium und ein wenig Lithium. Doch als die ersten Sterne aufleuchteten, bildete die Kernfusion in ihrem Inneren weitere, schwerere Elemente – und damit potenzielle Reaktionspartner. Die Verbindung dieser Atome zu immer vielseitigeren chemischen Molekülen bildet erst die Grundlage der Welt, wie wir sie kennen.

Ein verborgenes Muster
Dass sich viele Stoffe in unserer Umwelt durch chemische Reaktionen zerlegen oder zu neuen Substanzen zusammenfügen lassen, entdeckten schon die Alchemisten des Mittelalters. Doch was das Wesen von Molekülen ausmacht und wie Atome miteinander eine Bindung eingehen, blieb ihnen noch verborgen.
Erst im 19. Jahrhundert erkannten Chemiker allmählich, dass die Elemente nicht willkürlich miteinander reagieren, sondern dabei einem bestimmten Muster folgen. Dieses wiederum spiegelt die Position des jeweiligen Atoms im Periodensystem der Elemente wider und demnach die Zahl der Protonen im Atomkern und der Elektronen in der Atomhülle. Je nach Zahl der Außenelektronen gibt ein Element bei einer chemischen Reaktion entweder Elektronen ab oder versucht, welche hinzu zu gewinnen.
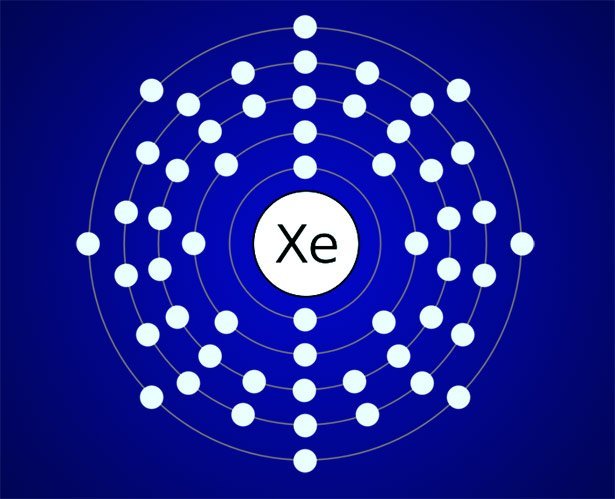
Oktettregel: Die „magische“ Acht
Anfang des 20. Jahrhunderts stellten Chemiker dafür die Oktettregel auf: Hauptgruppen-Elemente gehen demnach bevorzugt Bindungen ein, die ihnen acht Valenzelektronen einbringen. Diese Konfiguration entspricht dem Elektronenzustand der Edelgase und ist daher energetisch besonders günstig und stabil.
Alkalimetalle wie Natrium oder Kalium reagieren deswegen besonders stark mit Halogenen – einer Paarung, von der beide profitieren. Denn Halogene bringen sieben Valenzelektronen mit und sind daher dankbare Abnehmer für das einzige Außenelektron der Alkalimetalle. Ein Kohlenstoffatom bindet sich dagegen bevorzugt so, dass es zu seinen vier Außenelektronen vier weitere von einem Partner dazubekommt – beispielweise im Methan (CH4) von den vier Wasserstoffatomen.
Übergangsmetalle: Tiefe Schalen und bunte Farbenspiele
Anders ist dies bei den Übergangsmetallen. Weil bei ihnen auch weiter innen liegende Elektronenschalen an den Bindungen beteiligt sind, benötigen sie 18 Valenzelektronen für eine besonders stabile Konfiguration. Um diesen Zustand zu erreichen, bilden die Übergangselemente häufig Komplexverbindungen. Ein Beispiel ist das Eisenpentacarbonyl (Fe(CO)5), bei dem fünf Kohlenmonoxid-Gruppen das zentrale Eisenatom umgeben. Das Eisen mit acht Außenelektronen gewinnt durch diese Paarung zehn Valenzelektronen dazu und kommt so auf die stabile Konfiguration des Edelgases Krypton

Die besondere Konfiguration der Übergangsmetalle ist auch das Geheimnis ihrer faszinierenden Farbigkeit: Schon vor Jahrhunderten wurden Verbindungen von Elementen wie Mangan, Chrom oder Titan als Pigmente verwendet. So erstrahlt das Übergangsmetall Chrom beispielsweise je nach Bindungspartner als knalliges Chromgelb oder kräftiges Chromoxidgrün. Das Element erhielt sogar seinen Namen „Chroma“ vom griechischen Wort für Farbe.
Dahinter steckt die Wirkung der chemischen Bindung auf die Valenzelektronen der Übergangsmetalle: Die Interaktion mit den Partnern verändert die Energieniveaus ihrer Elektronen so, dass nur bestimmte Anteile des Lichts von ihnen absorbiert werden. Fehlen dadurch im reflektierten Licht beispielweise die roten Wellenlängen, nehmen wir die Verbindung als türkisblau wahr. Wurde grün absorbiert, erscheint uns das Molekül rot.
Nadja Podbregar
Stand: 12.10.2018








