Die T-Zellen unseres Immunsystems sind auch die Akteure in einer weiteren Variante der Immuntherapie gegen Krebs. Weil sie wegen der Tarnung vieler Tumore diese nicht von selbst erkennen und angreifen, werden sie künstlich „scharf gemacht“: Man stattet sie gentechnisch mit den Rezeptoren aus, die sie zum Andocken an die Krebszellen und deren Abtöten benötigen.
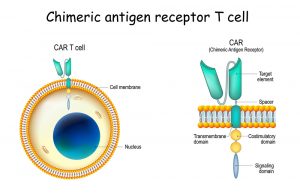
Maßgeschneiderte Andockstellen
Basis dieser in den 1990er Jahren entwickelten CAR-T-Zelltherapie ist ein gentechnisches Verfahren, durch das die T-Zellen der Krebspatienten sogenannte chimerische Antigen-Rezeptoren erhalten (CAR). Diese bestehen primär aus zwei Ketten eines krebsspezifischen Antikörpers, die auf einen aktivierenden Rezeptor der T-Zelle aufgesetzt werden. Dockt die Abwehrzelle mit diesem kombinierten Rezeptor an einer Krebszelle an, löst dies eine Signalkaskade in der T-Zelle aus, die diese aktiviert und ihre cytotoxischen Mechanismen in Gang setzt.
In der Praxis erwiesen sich solche CAR-T-Zellen der ersten Generation allerdings als nur wenig wirksam: Die solcherart manipulierten T-Zellen vermehrten sich nicht ausreichend und blieben zu inaktiv. Deshalb wurden seither CAR-Varianten der zweiten und dritten Generation entwickelt, bei der die künstliche Andockstelle mit zusätzlichen stimulatorischen Signalmodulen im Inneren der T-Zelle verknüpft ist.
Der Ablauf
Um die T-Zellen eines Krebspatienten mit diesen chimerischen Rezeptoren auszurüsten, nimmt man ihm Blut ab und isoliert daraus die T-Zellen. Im Labor wird eine virale Genfähre eingesetzt, um die für den zusätzlichen Rezeptor nötigen Gene in das Erbgut dieser T-Zellen einzuschleusen. Die auf diese Weise gentechnisch veränderten T-Zellen produzieren nun selbst die gewünschten Oberflächen- und Signalmoleküle – sie sind zu CAR-T-Zellen geworden.
Die CAR-T-Zellen werden nun im Labor vermehrt und dann dem Patienten mittels Infusion zurückgegeben. Damit sich diese „aufgerüsteten“ T-Zellen im Körper behaupten können, müssen die Krebspatienten zuvor eine Chemotherapie erhalten. Diese beseitigt einen Teil der Krebszellen und auch der körpereigenen, nicht auf den Krebs angepassten T-Zellen. Bis sich die CAR-T-Zellen im Körper ausreichend vermehrt haben, ist der Patient daher rund zwei Wochen lang stark immungeschwächt. Danach greift die Therapie allmählich und die „hochgerüsteten“ T-Zellen beginnen, die Krebszellen anzugreifen und zu vernichten.
Für Leukämien und Lymphome zugelassen
Bisher sind fünf CAR-T-Zelltherapien in den USA und der EU zugelassen. Sie werden zur Behandlung von Lymphomen und Leukämien eingesetzt, bei denen die B-Zellen des Patienten entartet sind und die nicht auf gängige Krebstherapien ansprechen. Die bisher am häufigsten eingesetzte CAR-T-Therapie, Tisagenlecleucel (Kymriah), erzielte in klinischen Tests eine Remission bei 80 Prozent der behandelten Leukämie-Patienten. Bei der gegen B-Zell-Lymphom eingesetzten Therapie mit Axicabtagen ciloleucel (Yescarta) blieben 65 Prozent der Patienten mindestens ein Jahr lang rückfallfrei.
Allerdings sind auch CAR-T-Zell-Therapien nicht ohne Nebenwirkungen. So führt die Aktivierung und Vermehrung der CAR-T-Zellen meist zu einer starken Freisetzung von entzündungsfördernden Cytokinen. Ähnlich wie dem von Virusinfektionen ausgelösten Cytokinsturm kann dieses Cytokin-Freisetzungs-Syndrom Symptome auslösen, die von grippeähnlichen Beschwerden bis zu schweren systemischen Entzündungen reichen. Zusätzlich kann die starke Aktivierung der T-Zellen ähnlich wie bei den Checkpoint-Inhibitoren Überreaktionen des Immunsystems verursachen.
Armierte CAR-T-Zellen auch gegen feste Tumore
Trotz erster Erfolge wirken CAR-T-Therapien bisher nur gegen frei im Blut oder der Lymphe flotierende Krebszellen. Gegen solide Tumore haben sie dagegen nur begrenzte bis keine Wirkung. „Bei festen Tumoren müssen die T-Zellen mehrere Barrieren überwinden, um an den Krebsherd zu gelangen“, erklärt Elizabeth Hawkings vom Institute of Cancer Research in London. Die Abwehrzellen haben dadurch oft Schwierigkeiten, in das dichte Tumorgewebe vordringen. „Aber selbst, wenn den T-Zellen dies gelingt, sind sie dann mit der hochgradig immundämpfenden Tumor-Mikroumgebung konfrontiert“, so Hawkings. Die Krebszellen setzen Botenstoffe frei, die die T-Zellen ruhigstellen und entwaffnen.
Um dies zu verhindern, arbeiten Wissenschaftler bereits an einer neuen, vierten Generation der CAR-Therapie. Bei dieser werden die T-Zellen mit weiteren „Waffen“ ausgestattet: Bei Kontakt mit der Krebszelle aktivieren ihre chimärischen Antigen-Rezeptoren zusätzlich die Freisetzung von immunaktivierenden Botenstoffen und teilweise sogar von Checkpoint-Inhibitoren. Die T-Zelle produziert dadurch selbst Antikörper, die ihre „Bremsen“ lösen und ihre Aktivität hochregulieren. Erste Therapien mit solchen armierten CAR-T-Zellen sind im Test, aber noch nicht zugelassen.
Das Problem des Aufwands
Doch es gibt ein weiteres Problem: Die CAR-T-Zell-Therapie ist so aufwendig und teuer, dass sie bisher nicht breit anwendbar ist. Dies liegt vor allem an der individuellen, für jeden Patienten spezifischen Herstellung der T-Zellen. So kann die gegen die B-Zell-Leukämie eingesetzte Tisagenlecleucel-Therapie pro Patient mehr als 450.000 Euro kosten – indirekte Kosten noch nicht mit eingerechnet. Andere CAR-Therapien sind kaum günstiger. Zudem können nur wenige medizinische Zentren diese Therapie anbieten. Die nötige Technik und Zertifizierung haben in Deutschland zurzeit nur rund 15 Universitätskliniken.
Hinzu kommt der Zeitfaktor: Um die T-Zellen eines Krebspatienten umzurüsten, dauert es rund drei Wochen. Der auf die CAR-T-Therapie spezialisierte Krebsforscher Sattva Neelapu von der University of Texas schätzte kürzlich, dass rund zehn bis 15 Prozent der für diese Therapien zugelassenen Patienten sterben oder zu krank sind, bis ihre T-Zellen zur Verfügung stehen.

Genschere statt viraler Genfähren
Um dieses Problem zu überwinden, arbeiten Forschende zurzeit an neuen, schnelleren und günstigeren Verfahren für die gentechnische Aufrüstung der T-Zellen. So hat ein Team um Antoni Ribas von der University of California in Los Angeles im Jahr 2022 erstmals die T-Zellen von 16 Patienten nicht mit einer viralen Genfähre, sondern mit der Genschere CRISPR/Cas9 genetisch verändert.
Der Vorteil: Durch dieses Verfahren können in einem Schritt die Gene für die neuen CAR-Module ins Erbgut der Abwehrzellen eingebaut und die zelleigenen, weniger wirksamen Rezeptorgene ausgeschnitten werden. Der Versuch, diese Methode gegen feste Tumore einzusetzen, war jedoch nur bedingt wirksam: Bei elf der 16 Patienten wuchs der Krebs weiter. Ribas und sein Team arbeiten jedoch an weiteren Optimierungen und sind zuversichtlich, die Wirksamkeit erhöhen zu können.
Fremde T-Zellen statt der eigenen?
Ein anderer Ansatz besteht darin, die CAR-Therapie stärker zu standardisieren – indem man nicht die individuellen T-Zellen der Patienten verwendet, sondern schon zuvor im Labor vermehrte T-Zellen gesunder Spender. Das hätte den Vorteil, dass diese Therapie günstiger und einfacher wäre und auch bei Krebspatienten anwendbar, deren eigene T-Zellen schon zu stark durch den Krebs oder die Chemotherapie geschädigt sind. Der Nachteil jedoch: Das Immunsystem greift die fremden T-Zellen an und muss daher ähnlich wie bei einer Transplantation durch immunsuppressive Mittel unterdrückt werden. Das jedoch macht die Patienten anfällig für Infektionen und kann auch dem Tumor zugutekommen.
2020 erbrachte eine erste Phase-1-Studie mit solchen allogenen CAR-T-Zellen dennoch vielversprechende Ergebnisse. Bei den 22 Patienten mit Lymphom schrumpften die Tumore und bei 40 Prozent der Patienten verschwanden sie sogar komplett. „Die Ansprechrate war damit etwa im gleichen Bereich wie bei CAR-T-Therapien mit körpereigenen Zellen“, berichtete Neelapu in „Nature“. Auch die Nebenwirkungen seien vergleichbar gewesen. Aber auch diese Therapie-Methode steht erst ganz am Anfang. Ob solche standardisierten CAR-T-Zelltherapien eines Tages zu wichtigen Waffen gegen Krebs werden, ist daher noch offen.