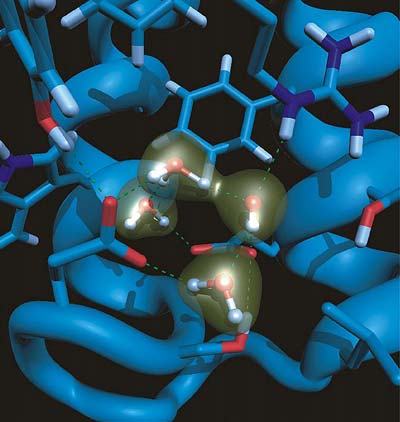
Rasend schnell können Bakterien Protonen durch ihre Zellmembran nach außen transportieren. Wie diese lichtbetriebene „Pumpe“ im Detail funktioniert, haben Wissenschaftler jetzt herausgefunden. Dank virtuellem Labor im Supercomputer konnten sie beobachten, wie die Wassermoleküle im Innern des Proteins kleine Ketten bilden und die Protonen wie ein „Nano-Stromkabel“ bis auf die Außenseite der Zellmembran leiten.
Wasser und Proteine: Innen nass
Wissenschaftler der DFG-Forschergruppe 436 „Grenzflächenwasser“ an der Ruhr-Universität untersuchten die Wirkungsweise des Farbstoffs Bakteriorhodopsin, der eine entscheidende Rolle in diesem Transportgeschehen spielt. Der eigentliche Transportprozess lässt sich experimentell jedoch nur schwierig untersuchen. Eine der wenigen Möglichkeiten dazu ist die zeitaufgelöste Infrarotspektroskopie. „Deren Ergebnisse, die Infrarot-Spektren, geben deutliche Hinweise darauf, dass internes Wasser eine wesentliche Rolle beim Transport von Protonen durch Bakteriorhodopsin spielt“, erklärt Dominik Marx, Professor für theoretische Chemie. „Das stützt die Auffassung, dass Wasser in vielen natürlich vorkommenden Proteinen nicht nur sozusagen ein passiver Beobachter ist, sondern im Gegenteil, eine wesentliche funktionelle Rolle spielt.“
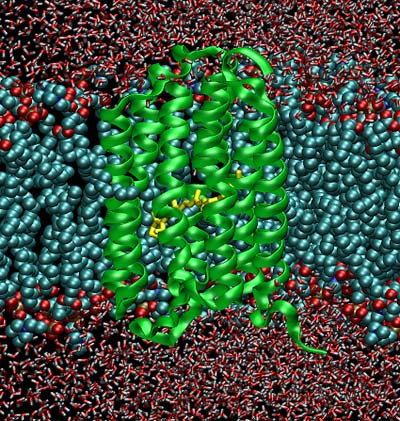
Das Bakteriorhodopsin arbeitet wie eine mit Lichtenergie angetriebene Pumpe, die Protonen gegen einen 10.000-fachen Konzentrationsunterschied durch die Zellmembran aus der Zelle heraus drückt. Es reicht durch die Zellmembran hindurch und bildet sieben Spiralen, die so gepackt sind, dass sie eine Röhre bilden, in die sich kleine „Wasserpfützen“ einlagern können. So entsteht ein wassergefüllter Kanal für den kontrollierten Transport von Protonen durch die Zellwand.
Allerdings lassen sich auch die mittels Infrarotspektroskopie gewonnenen Spektren nicht unmittelbar und eindeutig in atomistisch aufgelöste Bilder übersetzen. „Der Clou besteht darin, dass sich einzelne Wassermoleküle während der Wanderung der Protonen permanent zersetzen und wieder zusammensetzen, also andauernd kleinen chemischen Reaktionen unterworfen sind. Wie wir seit Jahren für verschiedene Systeme zeigen konnten, erklärt erst dieses Phänomen die rasant schnelle Bewegung von Protonen in Wassernetzwerken, und womöglich auch die Effizienz von Bakteriorhodopsin“, erläutert Marx.
Virtuelle Experimente: Tiefe Einblicke mit TeraFlops
Marx und seine Mitarbeiter bedienen sich daher eines „virtuellen
Labors“: Sie untersuchen seit Jahren die Bewegung von Protonen in Wassernetzwerken mit modernsten Computersimulationen. Im Fall von Bakteriorhodopsin mussten sie erstmals eine so genannte Multiskalenmethode einsetzen, um die lokale Situation des Protons genau beschreiben und gleichzeitig die Umgebung in die Rechnung einbeziehen zu können, also das Protein selbst, aber auch die Zellmembran und die umgebende Zellflüssigkeit.
„Diese biophysikalische Fragestellung war eine enorme Herausforderung für uns, so dass unsere Arbeiten erst nach mehreren Jahren zum Durchbruch geführt haben“, so Marx. Anhand von Computersimulationen gelang ihm nun zusammen mit Gerald Mathias der direkte Nachweis, dass bestimmte Infrarotsignale der bakteriellen Protonenpumpe von eingelagerten Wassermolekülen stammen, die ein zusätzliches Proton beherbergen. „Man kann sich vorstellen, dass dieser Wassercluster wie ein Schwamm Protonen aufnehmen, speichern und wieder abgeben kann“, veranschaulicht Dr. Mathias. Letztlich wird dieses Proton nach Lichteinfang des Proteins an die Außenseite der Bakterienmembran abgegeben. Der Prozess ermöglicht so bakterielle Photosynthese und damit Leben.
Von Clustern, Ketten und Quantenmechanik
„Interessanterweise scheinen die eingelagerten Wassermoleküle kleine Ketten zu bilden, entlang derer sich das Proton leicht fortbewegen kann“, so Mathias. „Man kann nun spekulieren, dass solche Ketten oder ‚Drähte‘ die Protonen durch die Zellwand leiten, ähnlich wie ein Kupferkabel den elektrischen Strom in der Wand.“
Um diesen Aspekt weiter zu untersuchen, kam Dr. Alain Chaumont als Humboldt-Stipendiat an den Lehrstuhl von Marx. Überraschend für die Forscher waren die sehr niedrigen Energiebarrieren, die das Proton während seiner Reise überwinden muss. Die virtuellen Experimente geben indirekte Hinweise darauf, dass sogar quantenmechanische Prozesse, die so genannten Nullpunktschwingungen, relevant sind und eine zusätzliche „Schmiere“ für den Prozess liefern.
„Wie so oft in der Wissenschaft wird ein Problem gelöst, aber gleichzeitig werden neue Fragen aufgeworfen“, so Marx. „Um sie zu untersuchen müssen wir allerdings unsere Simulationsmethode weiterentwickeln – im Kopf klappt das schon, aber es muss noch programmiert werden …“
(Ruhr-Universität Bochum, 18.04.2007 – NPO)