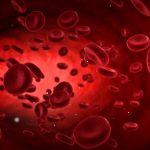
Weiße Blutkörperchen und Malaria-infizierte rote Blutkörperchen binden sich in Blutgefäßen mithilfe einer besonderen Strategie: Eine "Igelfrisur" aus speziellen Haftbereichen hilft ihnen bei der Haftung. Wie Wissenschaftler jetzt mithilfe aufwändiger Computersimulationen herausgefunden haben, sind dabei nicht Zahl oder Größe dieser Haftbereiche entscheidend, sondern vielmehr, wie weit sie aus der Zelloberfläche herausragen. Das berichten die Forscher in der Fachzeitschrift Physical Review Letters.
Das Blut ist das universelle Transportmittel für verschiedenartige Zellen in unserem Körper. Ihre Bewegung wird durch hydrodynamische Kräfte bestimmt. Die Zellen "ankern" dann an der Gefäßwand des Zielgewebes mit Hilfe spezieller Haftmoleküle, auch Rezeptoren genannt, die sich in vielen Fällen auf der Zelloberfläche in nanometergroßen Haftflecken sammeln. Der Vorgang der Anhaftung basiert auf dem Schlüssel-Schloss-Prinzip, das heißt, ein bestimmtes Haftmolekül bindet in der Regel nur ganz spezielle Partner. So wird garantiert, dass die Zellen nur dort hängen bleiben, wo sie ihre biologische Funktion erfüllen sollen.
Diese Prozesse sind von hoher medizinischer Relevanz; so haften Malaria-infizierte rote Blutkörperchen an Gefäßwänden, um ihrer Vernichtung in der Milz zu entkommen, und weiße Blutkörperchen docken bei ihren Patrouillengängen an den Gefäßwänden an, um anschließend im angrenzenden Gewebe Fremdkörper aufzuspüren. Zu den "wandernden Klebezellen" gehören auch Stammzellen, die aus dem Knochenmark zu ihrem Zielgewebe ziehen, sowie Krebszellen, die im Körper metastasieren.
Haftfleck sucht Partner
Um diese Vorgänge besser zu verstehen, muss man das Zusammenspiel von Hydrodynamik und molekularer Bindung der Haftflecken im Detail nachvollziehen. Die Wissenschaftler vom Max-Planck-Institut für Kolloid- und Grenzflächenforschung in Potsdam und von der Universität Heidelberg haben zu diesem Zweck ein Computermodell entwickelt, das systematisch untersucht, wie Dichte, Größe und Höhe der Rezeptoransammlungen die Haftung beeinflussen. In Millionen von Computerexperimenten ermittelten die Forscher, wie lange es in Abhängigkeit von diesen Größen dauert, bis der Haftfleck einen Partner auf dem Zielgewebe gefunden hat, während ein Flüssigkeitsstrom die Zelle nach den Gesetzen der Hydrodynamik bewegt. Diese Rechnungen sind sehr aufwändig, weil sie pro Zelle hunderte Flecken berücksichtigen müssen.
In den ersten Simulationen, die den Einfluss der Fließgeschwindigkeit auf die Haftung untersuchten, zeigte sich: Je schneller die Flüssigkeit fließt, desto rascher finden sich auch die Bindungspartner, da die Zelle eine größere Fläche abtasten kann. Anschließend variierten die Forscher die Flecken-Dichte und stellten fest, dass jenseits eines Schwellenwertes von einigen Hundert Rezeptorbereichen pro Zelle eine weitere Beschleunigung der Bindungsentstehung nicht mehr eintritt, denn von da ab überschneiden sich die durch thermische Zufallsbewegung entstehenden effektiven Wirkungsradien der Flecken. Ähnlich verhält es sich mit der Größe der Haftbereiche, der offenbar nur eine untergeordnete Rolle für die Bindungseffizienz spielt.
Höhe entscheidend
Verändert man aber die Höhe, mit der die Haftflecken über die Zellmembran hinausstehen, kommt man zu einem überraschenden Ergebnis: Bereits kleine Erhöhungen bewirken eine erheblich schnellere Bindung. Diesen Effekt nutzen weiße Blutkörperchen, indem sie sich mit Hunderten von Ausstülpungen bedecken, den so genannten "Mikrovilli", die etwa 350 Nanometer über die Zelloberfläche ragen, was immerhin fast vier Prozent des Zelldurchmessers ausmacht. Auch Malaria-infizierte rote Blutkörperchen verwenden die "Igelfrisur"-Strategie. Auf ihrer Oberfläche befinden sich 20 Nanometer hohe "Knospen".
Die Wissenschaftler vermuten, dass sie mit ihren Simulationen ein allgemeines biologisches Designprinzip aufgedeckt haben, das auch in anderen hydrodynamischen Zusammenhängen auftritt – beispielsweise bei Bakterien, die sich in medizinischen Durchflussgeräten wie Kathetern oder Dialysen ansammeln. Die entwickelte Software wird es in Zukunft erlauben, solche Situationen viel genauer als bisher zu untersuchen und ist ein weiterer Schritt auf dem Weg zu einer "berechneten" Biologie.
(MPG, 24.10.2006 – NPO)