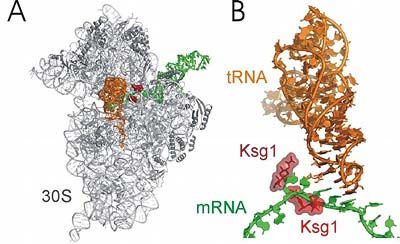
Antibiotika gehören zu den wichtigsten Waffen gegen Krankheitserreger. Aber wie genau wirken sie? Einen direkten Einblick darin haben jetzt deutsche und japanische Wissenschaftler erhalten. Denn ihnen gelang es, die Struktur der kleinen ribosomalen Untereinheit des Bakteriums Thermus thermophilus mit dem daran gebundenen Antibiotikum Kasugamycin aufzuklären. Wie sie in der Fachzeitschrift „Nature Structural and Molecular Biology“ beschreiben, blockieren jeweils zwei Kasugamycin-Moleküle die mRNA-Bindungsstelle des Ribosoms verhindern dadurch eine Proteinproduktion.
Ribosomen sind in allen Zellen für die Bildung der Proteine verantwortlich. Sie setzen sich aus zwei Untereinheiten zusammen, einer kleinen Untereinheit (30S), die für die mRNA-Erkennung und damit für die Übersetzung des genetischen Codes verantwortlich ist, und einer großen Untereinheit (50S), welche die Aminosäuren zu einer Kette verknüpft. Die Bildung von Proteinen ist von vitaler Bedeutung für das Überleben aller Organismen, es bestehen jedoch eine Reihe von Unterschieden zwischen den Ribosomen von Bakterien, Pilzen, Pflanzen und Tieren. Eine genaue Kenntnis des Ablaufs der Proteinsynthese sowie der Struktur der jeweils beteiligten Elemente ist daher unerläßlich für die Entwicklung wirksamer Antibiotika, die beispielsweise nur auf bestimmte Zellarten wie Bakterien oder Pilze einwirken können, ohne die befallenen Wirte (Pflanzen oder Tiere) zu schädigen.
Synthese von Proteinen gestört
Wissenschaftlern des Berliner Max-Planck-Instituts für molekulare Genetik ist es jetzt in Zusammenarbeit mit einer Arbeitsgruppe des RIKEN Instituts in Japan gelungen, die Struktur der kleinen 30S- Untereinheit des Ribosoms des Bakteriums T. thermophilus aufzuklären, an welche das Antibiotikum Kasugamycin gebunden ist. Die Forscher unter der Leitung von Dr. Paola Fucini fanden heraus, dass jeweils zwei Kasugamycin-Moleküle an eine funktionell wichtige Region der 30S-Untereinheit binden.
Die Moleküle blockieren dadurch die Bindungsstelle für die mRNA, so dass diese nicht mehr richtig an das Ribosom gebunden werden kann. In der Folge wird auch die Wechselwirkung des Moleküls mit der mRNA gestört, welches die Aminosäuren für die Zusammensetzung der Proteine an das Ribosom herantransportiert ("Initiator-tRNA). Auch die Initiator-tRNA kann somit nicht mehr an das Ribosom binden, die Synthese von Proteinen wird dadurch vollständig verhindert.
Anwendungen in Landwirtschaft und Medizin
Die Erkenntnisse der Wissenschaftler sind von großer Bedeutung insbesondere für die Landwirtschaft. Kasugamycin kann die äußere Zellmembran von Bakterien und Pilzen durchdringen, in die Zellen von Pflanzen und Tieren gelangt es jedoch nicht. Es wird daher seit Jahren zur Bekämpfung der sogenannten Blattbräune (Rice Blast Disease) eingesetzt, einer Pilzerkrankung von Reispflanzen, die jedes Jahr zu erheblichen Verlusten in der Landwirtschaft vor allem im asiatischen Raum führt.
Die jetzt veröffentlichte Struktur verdeutlicht die genaue Interaktion des Kasugamycins mit der 30S-Untereinheit und erklärt, warum bereits kleine Veränderungen (Mutationen) an der 30S- Untereinheit des Ribosoms eine Resistenz gegenüber dem Antibiotikum bewirken können. Dies eröffnet den Weg für die Entwicklung wirkungsvollerer Antibiotika, mit denen ein Teil der steigenden mikrobiellen Resistenzen überwunden werden könnte.
(Max-Planck-Institut für molekulare Genetik, 26.09.2006 – NPO)