Chemiker haben neue Einblicke in eines der größten Mysterien des Wassers gewonnen: seine Eigendissoziation. Dieser spontane Zerfall von Wassermolekülen in Ionen macht das Wasser zu einem so guten Lösungsmittel. Doch wie dieser Zerfall im Einzelnen abläuft und unter welchen Bedingungen, war bisher nur in groben Zügen bekannt. Jetzt haben Forscher die Eigendissoziation erstmals im Computer nachvollzogen und modelliert, wie sie im Fachmagazin „Scientific Reports“ berichten.
Wasser ist in gleich mehrerer Hinsicht eine ungewöhnliche Substanz: Es bildet beim Gefrieren je nach Druck und Temperatur gut ein Dutzend verschiedener Eisformen, kann aber andererseits sogar bei gut 40 Grad unter Null flüssig bleiben. Die Wechselwirkungen der Wassermoleküle untereinander verursachen zudem für die Dichteanomalie und machen Wasser zu einer Flüssigkeit mit zwei verschiedenen Strukturvarianten.
Spontaner Zerfall
Jetzt haben Eva Perlt von der Universität Bonn und ihre Kollegen ein weiteres Geheimnis des Wassers gelüftet: die sogenannte Eigendissoziation. Eigentlich sind die Bindungskräfte innerhalb des Wassermoleküls so stark, dass sein spontaner Zerfall extrem unwahrscheinlich ist. Dennoch zeigen Messungen, dass selbst reines Wasser eine geringe Leitfähigkeit besitzt.
Das aber ist nur dann zu erklären, wenn zumindest ein kleiner Teil der Wassermoleküle zerfällt: in ein negativ geladenes Hydroxid-Ion (OH–) sowie ein positiv geladenes Hydronium-Ion (H3O+). „Diese Eigendissoziation bildet die Grundlage für viele Säure-Base-Reaktionen – also für alles, was mit dem pH-Wert zusammen hängt“, erklärt Perlt. Ohne diese zentrale Eigenschaft wäre Leben, wie wir es kennen, wohl auf der Erde nicht denkbar.
„Eines der größten Mysterien“
Diese Reaktion ist jedoch ausgesprochen selten: Auf zehn Milliarden Wassermoleküle kommen nur 36 Ionen. Zudem neigen die Ionen dazu, sich direkt wieder zu verbinden. Diese Dynamik macht es schwer, das sogenannte Ionenprodukt des flüssigen Wassers physikalisch zu erfassen. „Das Ionenprodukt des flüssigen Wassers bleibt eines der größten Mysterien von Studien der Flüssigphase – es gibt praktisch keine mechanistische Erklärung“, so die Chemiker.
Einer der Gründe: Der Zerfall der Wassermoleküle entzieht sich klassischen Simulationen mittels Computermodellen. „Da die Eigendissoziation so selten ist, müssten wir dazu im Rechner viele Milliarden Teilchen simulieren“, erklärt Perlt. „Das übersteigt schlicht die Leistung der heute verfügbaren Hardware.“
Die Cluster sind der Schlüssel
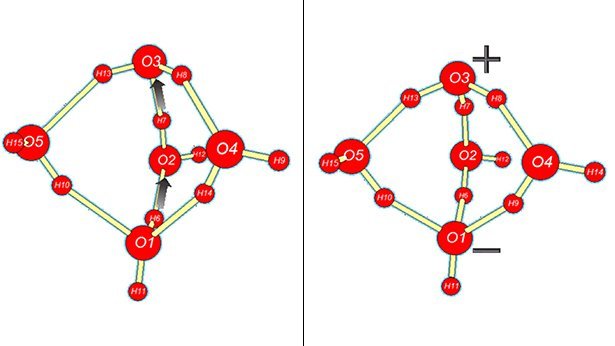
Durch einen Trick ist dies Perlt und ihren Kollegen nun trotzdem gelungen. Der Clou dabei: Sie nutzten die Tatsache aus, dass Wassermoleküle polar sind. Die Moleküle tragen an ihren Atomen schwache Teilladungen – und besitzen damit wie kleine Magneten gewissermaßen einen Nord- und einen Südpol. In Lösung ordnen sie sich daher zu lockeren räumlichen Strukturen an, sogenannten Clustern.
Manche dieser Cluster bieten ein Milieu, in dem sich Ionen besonders wohl fühlen. Sie schaffen eine Art Mikroumgebung, die die Eigendissoziation fördert. „Wir haben nun in unserem Modell berechnet, welche Arten von Clustern in flüssigem Wasser vorliegen“, erklärt Perlts Kollegin Barbara Kirchner. „Dadurch konnten wir die Komplexität des Modells erheblich reduzieren.“
Umlagerungen im Molekülcluster
Aus der Zusammensetzung der Cluster konnten die Chemiker auf die Wahrscheinlichkeit schließen, mit der die Wassermoleküle dissoziieren. Vor allem aber ermöglichte ihre Methode es, die Kinetik und Reaktionswege nachzuvollziehen, durch die die Wassermoleküle in den Clustern zerfallen. Das Modell zeigt beispielsweise, welche Protonenumlagerungen in den verschiedenen Clusterstrukturen stattfinden und welche Energien und Energiebarrieren dafür eine Rolle spielen.
Dadurch gelang es den Forschern, auch die Temperaturabhängigkeit des Zerfalls nachzuvollziehen. „Zwischen dem Schmelz- und dem Siedepunkt des Wassers nimmt die Selbstdissoziation um etwa den Faktor 1.000 zu“, erläutert Ralf Ludwig von der Universität Rostock. „Diese Zunahme wird auch von unserer Computersimulation vorhergesagt.“ Das Ergebnis ihrer Berechnungen deckt sich damit hervorragend mit den Werten, die sich in der Natur beobachten lassen. (Scientific Reports, 2017; doi: 10.1038/s41598-017-10156-w)
(Rheinische Friedrich-Wilhelms-Universität Bonn, 04.09.2017 – NPO)