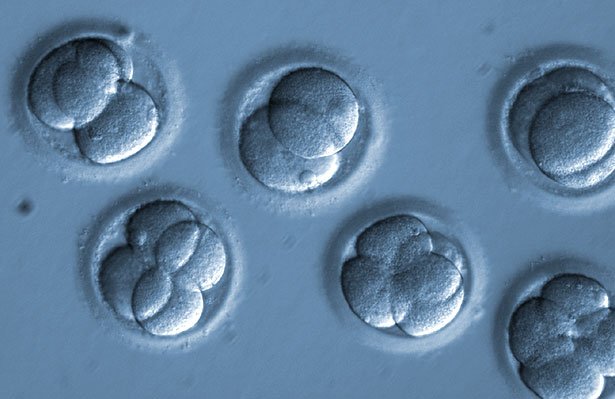
Eingriff in die Keimbahn: Erstmals haben Forscher eine Erbkrankheit schon in der befruchteten Eizelle repariert. Mit der Genschere CRISPR/Cas9 korrigierten sie einen Gendefekt, der eine erbliche Herzkrankheit verursacht. Neu daran: Ihre Methode hatte eine höhere Erfolgsquote als alle bisherigen Ansätze und führte zu weniger unerwünschten Nebeneffekten. Ein solcher Eingriff in die Keimbahn ist jedoch stark umstritten – und bei uns verboten.
Genreparaturen an befruchteten Eizellen und Embryonen sind in vielen Ländern – auch in Deutschland – bisher verboten. Der Grund dafür: Wird an dem Erbgut dieser Zellen etwas verändert, dann wirkt sich dies nicht nur auf diesen Menschen aus, sondern auch auf alle seine Nachkommen. Solche Eingriffe in die Keimbahn sind daher ethisch stark umstritten. Andererseits aber bieten sie die Chance, Erbkrankheiten sozusagen an der Wurzel zu beseitigen – und so kommende Generation vor ihnen zu schützen.
Genschere machts möglich
Bisher blieb die Debatte um Keimbahn-Eingriffe eher theoretisch, weil die gentechnischen Methoden noch nicht weit genug fortgeschritten waren. Doch mit der Genschere CRISPR/Cas9 werden Genreparaturen immer effektiver und sicherer – und damit rückt die Genkorrektur bei menschlichen Embryos in den Bereich des Machbaren.
In China haben Forscher bereits mehrfach in das Erbgut menschlicher Embryos eingegriffen. Ein Team reparierte den Gendefekt, der die erbliche Blutkrankheit Thalassämie verursacht, ein anderes schleuste eine Mutation ins Embryo-Genom ein, die die Zellen gegen HIV immun machen sollte. Allerdings: Die Erfolgsquote war bei diesen Experimenten gering und es trat ein Mosaikeffekt auf: Einige Zellen des Embryos tragen die Genveränderung, andere nicht.
Erbliche Herzkrankheit als Testfall
Deutlich erfolgreicher waren nun Hong Ma von der Oregon Health & Science University in Portland und sein Team. Denn sie haben erstmals einen erblichen Gendefekt schon in der befruchteten Eizelle repariert – und dies mit überraschend wenig unerwünschten Fehleinfügungen oder Schneidefehlern im Erbgut.
Für ihr Experiment nutzten sie Spermien eines Mannes, der an hypertropher Kardiomyopathie (HCM) leidet. Diese erbliche Herzerkrankung betrifft einen von 500 Menschen und führt schon in jungem Alter zu Herzrhythmusstörungen, plötzlichem Herzversagen und dem Tod. Bei etwa 40 Prozent der Fälle wird die Erbkrankheit durch eine Mutation im MYBPC3-Gen verursacht. Diese Mutation ist dominant: Es reicht aus, wenn nur eine Genkopie mutiert ist, um die Krankheit auszulösen.
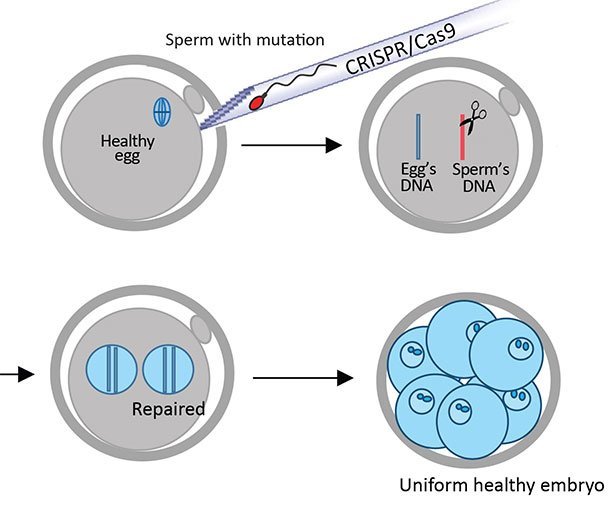
Genreparatur schon bei der Befruchtung
Die Forscher gaben jeweils ein Spermium des kranken Spenders in eine gesunde Eizelle. Gleichzeitig injizierten sie die Genschere CRISPR/Cas9 und Kopien des korrekten, nichtmutierten DNA-Codes in die Eizelle. Dadurch war die Genschere bereits in der Phase präsent, in der das Erbgut von Spermium und Eizelle miteinander verschmelzen. Dies sollte verhindern, dass Mosaik-Embryos entstehen, wie bei bisherigen Methoden meist der Fall.
Eine weitere Besonderheit: Die Genschere schnitt nur die defekten vier DNA-Basen aus dem Genom heraus. Das Einfügen der korrekten Ersatzsequenz überließen die Forscher den zelleigenen DNA-Reparaturmechanismen. Diese sind von Natur aus darauf ausgelegt, Defekte in der DNA zu flicken. Um diesem Reparatursystem eine Schablone zu liefern, hatten die Wissenschaftler die DNA-Schnipsel mit der korrekten Sequenz mitinjiziert.
Erfolgreich bei 42 von 58 Embryonen
Das Ergebnis: Die Genschere hatte bei allen Embryonen zielgenau die defekte DNA-Sequenz herausgeschnitten – ihre Trefferquote lag bei 100 Prozent, wie die Forscher berichten. Die zelleigene DNA-Reparatur hatte dann bei 42 der 58 Embryonen den Gendefekt korrekt repariert, dies entspricht 72,2 Prozent. Ohne die Genbehandlung hätte die Hälfte der Embryonen das defekte Gen bekommen.
„Noch wichtiger aber: Alle Blastomeren besaßen identische Genotypen, es gab keine Mosaik-Effekte“, berichten Ma und seine Kollegen. DNA-Analysen zeigten zudem, dass es in diesen 42 Zellen keine unerwünschten Genveränderungen außerhalb der Reparaturstelle gab. Trotz intensiver Suche konnten die Forscher keine Off-Target-Effekte nachweisen. Bei den knapp 28 Prozent restlichen Zellen jedoch gab es solche Effekte.
Reparatur verlief anders als gedacht
Überraschend dabei: Die Genreparatur passierte anders als die Forscher erwartet hatten. Denn die frisch befruchtete Eizelle nutzte in fast allen Fällen ihre eigene intakte Genkopie als Vorbild für die neu eingefügten Genbuchstaben. Dieser Mechanismus der Homologie-geleiteten Reparatur (HDR) sorgt für eine besonders präzise Reparatur ohne unerwünschte Fehler. Doch in normalen Zellen findet sie kaum statt.
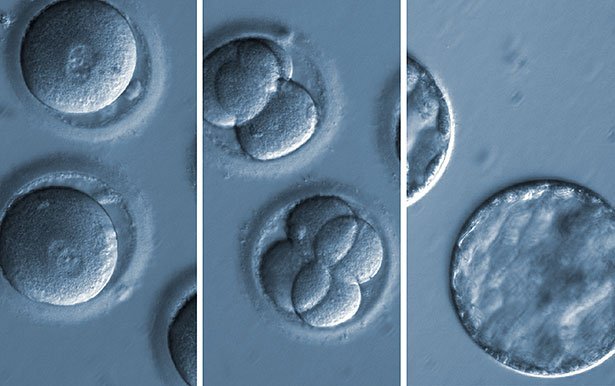
Im Embryo jedoch dominierte dieser präzisere Reparaturmechanismus. „Dieser erstaunliche Unterschied deutet darauf hin, dass menschliche Keimzellen und Embryonen andere DNA-Reparatursysteme nutzen – möglicherweise, weil es evolutionär so wichtig ist, die Keimbahn genetisch korrekt zu halten“, sagen Ma und seine Kollegen.
Für künftige Gentherapien wäre dies eine gute Nachricht. Denn offenbar verhindert die HDR-Reparatur die gefürchteten Off-Target-Effekte und erhöht so die Sicherheit der Genreparatur beträchtlich.
„Ethische Debatte muss nun aufholen“
„Unsere Ergebnisse demonstrieren damit das große Potenzial einer Gentherapie am Embryo“, konstatiert Koautor Juan Carlos Izpisua Belmonte vom Salk Institute for Biological Studies. „Dank der Fortschritte in Gentechnik und Stammzelltechnologie können wir nun endlich beginnen, krankmachenden Mutationen anzugehen, unter denen Millionen von Menschen leiden.“
Doch die Forscher betonen auch, dass eine klinische Anwendung solcher Gentherapien noch in weiter Ferne liegt. „Die Gentherapie steckt noch in den Kinderschuhen, obwohl dieser vorläufige Versuch sich als sicher und effektiv erweisen hat“, so Belmonte. „Es entscheidend, dass wir mit der größten Vorsicht fortfahren und dabei ethischen Überlegungen größte Aufmerksamkeit schenken.“
Ähnlich sehen es auch andere Wissenschaftler: „Mit dieser Studie ist die Möglichkeit der Gentherapie an der Keimbahn von der Zukunftsfantasie in den Bereich des Machbaren gerückt“, kommentiert Peter Braude vom King’s College London. „Die Debatte darüber, ob und wie diese Methoden eingesetzt werden sollen, muss sich nun beeilen, um noch Schritt zu halten.“ (Nature, 2017; doi: 10.1038/nature23305)
(Nature, Salk Institute, Institute of Basic Science, Oregon Health & Science University, 03.08.2017 – NPO)