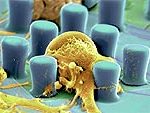
Eiweiße und Halbleiter sind bis dato zwei getrennte Welten. Ihre Zusammenführung verspricht jedoch ungeahnte Möglichkeiten, von der Erkennung biologisch relevanter Moleküle mittels neuartiger Sensoren bis zur Nutzung der natürlichen und steuerbaren biologischen Selbstorganisation für die Halbleitertechnologie. Jetzt haben Leipziger Physiker beide Welten erstmals zusammen gebracht.
{1l}
Aminosäuren sind die Bausteine des Lebens und ihre Abfolge in der DNS, dem Trägermolekül der Erbinformation, bestimmt Entwicklung und Eigenschaften aller lebenden Organismen. Die natürliche Selbstorganisation nach dem DNS-Code erzeugt aus der Erbinformation einer einzigen Zelle so komplexe Organismen wie den Menschen. Moleküle, die aus einer Abfolge von Aminosäuren bestehen, werden Peptide oder Eiweiße genannt.
Halbleiter wie Silizium oder Galliumarsenid bilden dagegen die Grundlage der modernen Kommunikationsgesellschaft. Ohne sie wären alle elektronischen und optoelektronischen Bauelemente undenkbar, beispielsweise Computerchips oder Laser in DVD-Spielern.
Haftung erforscht
Forschern der Universität Leipzig ist es gelungen, die Haftung von kurzkettigen Peptiden (bestehend aus zwölf Aminosäuren) auf verschiedenen Halbleitern systematisch zu studieren. Die Peptide wurden am Institut für Biochemie der Universität Leipzig hergestellt. Es zeigt sich zunächst, dass ein speziell für gute Haftung auf Galliumarsenid bekanntes Peptid auf Silizium fast gar nicht haftet. Dies liegt wahrscheinlich an der unterschiedlichen elektrostatischen Wechselwirkung der jeweiligen Peptide mit kleinen Ladungsungleichgewichten in den Bindungen der Atome, die den Halbleiter aufbauen. Die Bindung im Galliumarsenid zwischen Gallium und Arsen ist polar, die Bindung im Silizium zwischen zwei Siliziumatomen ist nicht-polar.
Eine von den Leipziger Physikern aufgestellte Regel auf der Basis dieser Ladungsunterschiede erklärt qualitativ die Größe der Peptid- Haftraten auf allen acht untersuchten Halbleiter-Oberflächen. Eine genauere mikroskopische und quantitative Erklärung ist nun eine Herausforderung an die Theorie. Dieses Problem wollen die Halbleiterphysiker mit Mitarbeitern der Theoretischen Physik der Universität Leipzig lösen, hier vor allem mit Dr. Michael Bachmann.
„Das Sensationelle an den Entdeckungen des Doktoranden Karsten Goede ist“, so der Direktor des Instituts für Experimentelle Physik II der Universität Leipzig, Prof. Dr. Marius Grundmann, „dass – ähnlich wie in lebender Materie – nicht nur die Art der beteiligten Aminosäuren eine Rolle spielt, sondern auch deren genaue Abfolge innerhalb des Peptides. Werden die Aminosäuren des Peptids in eine Zufallsfolge gebracht, verschwindet der Unterschied in den Haftraten auf Galliumarsenid und Silizium. Der Austausch von Aminosäuren, die für die elektrostatische Bindung wichtig sind, mit chemisch anderen Aminosäuren führt ebenso zu drastischen Änderungen der Haftung.“
(Universität Leipzig, 23.11.2004 – NPO)