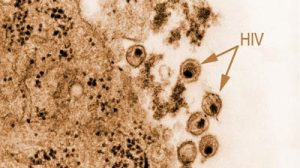
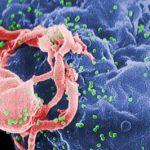
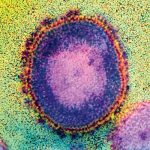
Forscher haben erstmals sämtliche Wechselwirkungen des Aidsvirus mit menschlichen Zellbestandteilen analysiert und kartiert. In der bisher größten Studie dieser Art kommen sie dabei auf insgesamt 497 Verbindungen von Proteinen des HI-Virus mit Proteinen der Wirtszellen. Nur 19 dieser Wechselbeziehungen seien zuvor bekannt gewesen. „Die neue Kartierung macht es nun leichter, genau zu verstehen, wie das Virus im Laufe der Infektion die Zellmaschinerie des Menschen kapert“, berichten die Wissenschaftler im Fachmagazin „Nature“.
{1r}
Nach Ansicht der Forscher eröffnen die neuen Erkenntnisse auch bisher unbekannte Möglichkeiten, das krankmachende Virus anzugreifen. „Haben wir neue Ansatzstellen für Medikamente entdeckt? Ich glaube schon“, sagt Studienleiter Nevan Krogan von der University of California in San Francisco. Denn viele dieser Proteinverbindungen könnten für die Vermehrung und das Überleben des Virus essenziell sein. Finde man einen Weg, um sie gezielt zu blockieren, könnte man so die Infektion verhindern.
Erste Ansatzstelle für Medikamente identifiziert
In einer zweiten, im gleichen Journal vorgestellten Studie haben Krogan und seine Kollegen eine der potenziell als Angriffsziel geeigneten Verbindungen bereits näher untersucht. Sie stellten fest, dass das Virenprotein Vif an ein Zellprotein andockt, das eigentlich die menschliche Zelle vor viralen Eindringlingen schützen soll. Doch das Virenprotein programmiere dieses Schutzmolekül um und ermögliche damit dem Aidsvirus erst die Infektion, berichten die Forscher. Gelänge es, diese Interaktion mit einem Medikament zu blockieren, könnte dies zu neuen Aidstherapien führen.
„Dies ist ein gutes Beispiel dafür, wie biophysikalische Studien unser Verständnis von Krankheiten verbessern und gleichzeitig Wege zu neuen Ansatzstellen für Therapien aufzeigen“, kommentiert Judith H. Greenberg, Leiterin des US-amerikanischen National Institute of General Medical Sciences (NIGMS) die Ergebnisse.
Aidsvirus besitzt nur 18 eigene Proteine
Das Erbgut des Aidsvirus ist zehntausend Mal kleiner als das des Menschen. Während die typische menschliche Zelle daher tausende unterschiedlicher Proteine enthält, produziert das HI-Virus nur 18 solcher Eiweißmoleküle. Diese reichen nicht aus, um alle biochemischen Werkzeuge bereitzustellen, die der Erreger für seine Vermehrung benötigt. Deshalb ist das Virus auf die Zellmaschinerie der von ihm infizierten menschlichen Zelle angewiesen, um sich zu vermehren.
Für ihre Studie klonten die Wissenschaftler zunächst die Gene aller 18 Proteine des HIV-1-Virus sowie weiterer viraler Moleküle und verknüpften sie mit einem Marker. Dies ermöglichte es ihnen, zwei menschliche Zelllinien gezielt zu infizieren und die einzelnen Virenproteine sowie deren Bindungspartner aus diesen Kulturen zu isolieren. In weiteren Analysen bestimmten die Forscher den Typ der mit den Virenproteinen verbundenen Zellproteine sowie deren Funktion. (Nature, 2011; doi: 10.1038/nature10719)
(Nature / dapd, 22.12.2011 – NPO)