Was Craig Mello und Andrew Fire 1998 entdeckten, erweist sich schnell als relativ simpler Mechanismus. So simpel, dass es viele Wissenschaftler geradezu erstaunt, dass er bis dahin völlig übersehen worden ist. Zuvor haben vor allem längere Stränge der RNA die Aufmerksamkeit der Forscher auf sich gezogen, eben jene Boten-RNA, die die Informationen der Gene dupliziert und zur Proteinproduktion in die Ribosomen außerhalb des Zellkerns schafft.
Doch bei den Arbeiten an Petunien, Kartoffeln und Fadenwürmern waren die Wissenschaftler zusätzlich auf viel kürzere RNA-Moleküle gestoßen, die ebenfalls in den Zellen herumschwammen. Die Entdeckung der RNA-Interferenz schließlich brachte zutage, dass eben jene kurzen RNA-Moleküle eine entscheidende Rolle beim Stummschalten der Gene spielen.
Zerhäckselt und getrennt
Die meisten Zellen enthalten ausschließlich lange, einsträngige RNA, die Boten-RNA (mRNA). Die kurzen RNA-Schnipsel dagegen sind das Produkt einer Abwehrreaktion der Zelle auf das Auftauchen von RNA-Molekülen, die wie die DNA im Zellkern aus zwei Strängen bestehen – meist aus Viren kommend, die der Zelle schaden könnten. Um diese fremde doppelsträngige RNA außer Gefecht zu setzen, wird sie im Zellkern durch ein Protein namens DICER („Häcksler“) in kleine Stücke gehackt. Diese kurzen doppelsträngigen RNA-Schnipsel sind jeweils 21 bis 23 Basenpaare lang – sowohl bei Fliegen als auch bei Säugetieren.
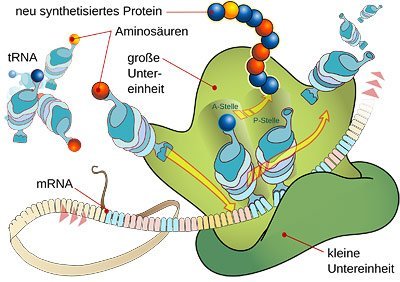
Anschließend werden die Schnipsel durch einen Enzymkomplex namens RISC (RNA-induced silencing complex) in Einzelstränge aufgetrennt. Die eine Hälfte wird sofort abgebaut, die andere Hälfte aber wirkt wie eine Art Magnet: Sie verbindet sich mit den zu ihr passenden Abschnitten von Boten-RNA, die gerade auf dem Weg zu den Ribosomen, den Proteinfabriken der Zelle ist. Dort, so der normale Ablauf, wird der Code der mRNA abgelesen und nach der darin festgelegten Blaupause ein Protein hergestellt. Doch die Anlagerung der vagabundierenden RNA-Schnipsel verhindert dies. Denn sie kennzeichnet nun die Proteinbauanleitung als zu zerstörendes Objekt, als überflüssigen Zellmüll.
Die Folge: Die Boten-RNA wird aufgehalten und zerstört und kann somit die Bauanleitung zur Produktion eines bestimmten Proteins nicht weitergeben. Das entsprechende Gen ist somit quasi ausgeschaltet. Soweit das Grundprinzip.

RNA-Schnipsel als Regulations-Helfer
Das eigentlich Überraschende ist aber eine andere Erkenntnis der Forscher: Denn auch ohne Manipulation von außen nutzen unsere Zellen offenbar genau diese RNA-Schnipsel, Mikro-RNA (miRNA) getauft, um zu regulieren, welche Gene erfolgreich zu Proteinen werden und welche nicht. Heute weiß man, dass die Mikro-RNAs bei einer Vielzahl von zellulären Prozessen als Schalthebel in Aktion treten: Bei Pflanzen regulieren sie das Wachstum oder die Blütenbildung, bei Tieren die Ausprägung der Fellfarbe und bei allen lebenden Organismen die Differenzierung von spezialisierten Zellen.
Wer aber bestimmt, welche dieser RNA-Stummschalter in der jeweiligen Zelle produziert werden? Interessanterweise liegen auch die Bauanleitungen für die Mikro-RNAs als Gene in unserem Erbgut. Das aber bedeutet, dass es noch etwas geben muss, das bestimmt, wann welche Mikro-RNA produziert wird. Aber was?
Stand: 26.02.2012